题目内容
11.现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系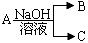 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途.一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
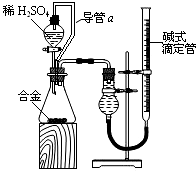
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和使测得的气体体积较准确,减少实验误差;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=$\frac{18({V}_{1}-{V}_{2})×1{0}^{-3}}{({m}_{1}-{m}_{2})}$L•moL-1.
分析 (1)若常温常压下,A为气态,且B、C中均有X元素,A为氯气,与NaOH溶液反应生成氯化钠、次氯酸钠与水;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则A为Si,工业上用碳与二氧化硅高温下反应制备Si,同时生成CO;
(3)若A为金属,C为气体,则A为Al,B为偏铝酸钠,C为氢气;
(4)①通过测量Al及硫酸与Al反应生成氢气的体积计算气体摩尔体积,可以消除加入硫酸排出气体的体积,使测得的气体体积较准确,减少实验误差;
②固体质量之差为Al的质量,前后液面读数为生成氢气的体积,结合电子转移守恒计算.
解答 解:(1)若常温常压下,A为气态,且B、C中均有X元素,A为氯气,与NaOH溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则A为Si,工业上用碳与二氧化硅高温下反应制备Si,同时生成CO,反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si;
(3)若A为金属,C为气体,则A为Al,B为偏铝酸钠,C为氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)①通过测量Al及硫酸与Al反应生成氢气的体积计算摩尔质量,可以消除加入硫酸排出气体的体积,使测得的气体体积较准确,减少实验误差,
故答案为:使测得的气体体积较准确,减少实验误差;
②Al的质量为(m1-m2)g,生成氢气的体积为(V1-V2)×10-3L,由电子转移守恒:$\frac{({V}_{1}-{V}_{2})×1{0}^{-3}}{{V}_{m}}$×2=$\frac{({m}_{1}-{m}_{2})g}{27g/mol}$×3,整理可得Vm=$\frac{18({V}_{1}-{V}_{2})×1{0}^{-3}}{({m}_{1}-{m}_{2})}$L•moL-1,
故答案为:$\frac{18({V}_{1}-{V}_{2})×1{0}^{-3}}{({m}_{1}-{m}_{2})}$.
点评 本题考查无机物的推断、化学定量实验,熟练掌握元素化合物的性质,(4)中关键是对实验原理的理解,是对学生综合能力的考查.

| A. | CaO | B. | Cl2 | C. | H2SO4 | D. | SO2 |
| A. | O4和O2互为同位素 | |
| B. | O4转化O2为物理变化 | |
| C. | 18O是氧元素的一种核素,它的中子数是8 | |
| D. | 同温同压下,等体积的O4气体和O2含有相同的分子数 |
①取部分溶液,逐滴滴入NaOH溶液至过量并微热,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.
下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl-,可能有K+ | |
| B. | 肯定有Al3+、Mg2+,可能有CO32- | |
| C. | 肯定有Al3+、Mg2+、Cl-,肯定没有NH4+ | |
| D. | 肯定有Al3+、Cl-,可能有Mg2+ |
| A. | 浓硫酸使胆矾晶体变白(脱水性) | |
| B. | 在加热条件下铜与浓硫酸反应(氧化性、酸性) | |
| C. | 蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) | |
| D. | 浓硫酸可用来干燥某些气体(不挥发性) |
 已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示:
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示: