题目内容
配制0.5L 1mol/L的盐酸需 molHCl,即需标况下HCl气体的体积为 L;现有73克HCl溶在适量水中,现配成1L溶液,其物质的量浓度为 mol/L,从中取出10ml,其物质的量浓度为 .
考点:溶液的配制
专题:化学实验基本操作
分析:根据n=
=
=
=cV结合分子的构成,以及c=
计算有关物理量.
| m |
| M |
| N |
| NA |
| V |
| Vm |
| n |
| V |
解答:
解:n=cV=0.5L×1mol/L=0.5mol;
V(HCl)=0.5mol×22.4L/mol=11.2L;
73克HCl的物质的量是1mol,c(HCl)=
=1mol/L;
浓度与体积无关,从中取出10ml,其物质的量浓度仍为1mol/L,故答案为:0.5;11.2;1;1mol/L.
V(HCl)=0.5mol×22.4L/mol=11.2L;
73克HCl的物质的量是1mol,c(HCl)=
| 1mol |
| 1L |
浓度与体积无关,从中取出10ml,其物质的量浓度仍为1mol/L,故答案为:0.5;11.2;1;1mol/L.
点评:本题考查物质的量的相关计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
相关题目
为了检验某晶体中是否含有NH4+、SO42-、Fe2+和结晶水,设计了下列操作步骤:
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
| A、实验②中发生反应的离子方程式为:Fe2++Cl2=Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3 |
| B、只做实验①③④,也能达到实验目的 |
| C、通过上述实验可确定该化合物化学式为:(NH4)2Fe(SO4)2?6H2O,是一种浅绿色晶体,商品名为摩尔盐 |
| D、为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
等体积、等物质的量浓度的Na2SO4和Na2CO3溶液中,阴阳离子总数相比( )
| A、前者多 | B、后者多 |
| C、一样多 | D、无法判断 |
在含有Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A、SO42- |
| B、NO3- |
| C、Cl- |
| D、CO32- |
下列说法错误的是( )
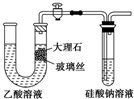

| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
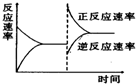 如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时使用催化剂 |
| D、增大反应物浓度,同时减小生成物浓度 |
氧化还原反应的实质是( )
| A、化合价的升降 |
| B、分子中各原子重新组合 |
| C、电子的得失或共用电子对的偏移 |
| D、氧原子的得失 |
在天平两端各放同浓度、同体积的足量盐酸于烧杯中,调整天平后,往左边烧杯中加入3.6g铝粉,为使天平最终达成平衡,应往右端烧杯中加入镁粉的质量是( )
| A、3.6g | B、3.93g |
| C、3.49g | D、3.70g |