题目内容
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+几种离子,请回答:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 (填离子符号).
(2)取少量试液加入过量稀盐酸有白色沉淀生成,过滤;然后取滤液加入过量的稀氨水(NH3?H2O)出现白色沉淀,则产生该沉淀的离子方程式为 .
(3)原溶液中可能大量存在的下列阴离子有: (填选项).
a、Cl- b、OH- c、CO32-d、NO3- e、SO42-.
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量试液加入过量稀盐酸有白色沉淀生成,过滤;然后取滤液加入过量的稀氨水(NH3?H2O)出现白色沉淀,则产生该沉淀的离子方程式为
(3)原溶液中可能大量存在的下列阴离子有:
a、Cl- b、OH- c、CO32-d、NO3- e、SO42-.
考点:离子共存问题
专题:
分析:溶液无色,则有颜色的Cu2+、Fe3+、不能存在,取少量试液加入过量稀盐酸有白色沉淀生成,说明含有Ag+,然后取滤液加入过量的稀氨水(NH3?H2O)出现白色沉淀,说明含有Mg2+,从离子共存的角度判断阴离子,以此解答该题.
解答:
解:(1)溶液无色,则有颜色的Cu2+、Fe3+、不能存在,故答案为:Cu2+、Fe3+;
(2)取少量试液加入过量稀盐酸有白色沉淀生成,说明含有Ag+,然后取滤液加入过量的稀氨水(NH3?H2O)出现白色沉淀,说明含有Mg2+,反应的离子方程式为Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;
(3)溶液中含有Ag+、Mg2+,则不可能存在Cl-、OH-、CO32-、SO42-,只能存在NO3-,故选d.
(2)取少量试液加入过量稀盐酸有白色沉淀生成,说明含有Ag+,然后取滤液加入过量的稀氨水(NH3?H2O)出现白色沉淀,说明含有Mg2+,反应的离子方程式为Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;
(3)溶液中含有Ag+、Mg2+,则不可能存在Cl-、OH-、CO32-、SO42-,只能存在NO3-,故选d.
点评:本题考查离子共存问题,为高频考点,侧重于学生的分析能力的考查,注意把握离子的性质以及反应类型的判断,难度不大,注意根据反应现象进行判断.

练习册系列答案
相关题目
用如图所示装置(必要时可加热试管),不能完成的实验是( )
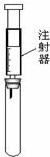

| A、试管中盛酚酞试液,验证氨气的水溶液呈碱性 |
| B、试管中盛酸性高锰酸钾溶液,探究SO2的还原性 |
| C、试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 |
| D、试管中盛淀粉KI溶液,验证氯气氧化性 |
下列说法不正确的是( )
| A、用水能鉴别乙酸、苯、四氯化碳 |
| B、用热的纯碱溶液能除去试管中的油脂 |
| C、往通了乙烯的溴水中加AgNO3溶液,生成淡黄色沉淀,说明乙烯与溴发生了加成反应 |
| D、通过钠与分子式为C2H6O的两种有机物作用的不同现象,说明乙醇存在同分异构体 |
下列说法正确的是( )
| A、两种难溶电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
| C、所谓沉淀完全就是用沉淀剂将溶液中的某一离子除净 |
| D、相同温度下,AgCl固体在0.01 mol?L-1 KI溶液中的溶解的质量比在0.01mol?L-1 KNO3溶液中大,但Ksp不变 |
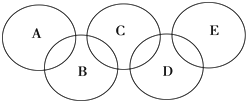 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素, ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:


