题目内容
14.下列说法正确的是( )| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
分析 A.离子键中阴阳离子间既存在静电吸引力也存在原子核间的排斥力;
B.原子的结构决定着元素的性质,元素周期律是元素原子核外电子排布周期性变化的结果;
C.同一周期,从左到右最高价氧化物对应水化物的酸性越强,必须指出最高化合价;
D.HF、HCl、HBr、HI的还原性依次增强.
解答 解:A.形成离子键的阴阳离子间既存在静电吸引力也存在原子核间的排斥力,故A错误;
B.原子的结构决定着元素的性质,最外层电子的排布呈规律性变化,则性质呈周期性变化,故B正确;
C.第三周期从左到右,元素的非金属逐渐增强,最高价氧化物对应水化物的酸性越强,但含氧酸的酸性没有此递变规律,故C错误;
D.非金属性越强,氢化物的稳定性越强,而阴离子的还原性越弱,则HF、HCl、HBr、HI的热稳定性依次减弱,但还原性依次增强,故D错误;
故选B.
点评 本题考查了离子键、元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,A为易错点,注意离子键中既存在静电吸引力也存在原子核间的排斥力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
4.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝4种溶液,这种试剂是( )
| A. | NH3•H2O | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1N |
2.将少量镁、铝合金投入到稀盐酸中,完全溶解后,再加入过量的氢氧化钠溶液,过滤,最后得到的沉淀是( )
| A. | Al(OH)3 | B. | Mg(OH)2和Al(OH)3 | C. | Mg(OH)2 | D. | MgO |
9.下列各组离子在溶液中可以大量共存的是( )
| A. | H+、NH4+、CO32- | B. | Fe3+、Cl-、NO3- | C. | Na+、OH-、HCO3- | D. | Al3+、OH-、NO3- |
19.下列各原子序数的元素,能形成AB2型离子化合物的是( )
| A. | 1与8 | B. | 9与11 | C. | 6与16 | D. | 12与17 |
6.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 甲苯 | D. | 二氧化硫 |
3.下列说法正确的是( )
| A. | 用核磁共振氢谱图可以鉴别乙醇和溴乙烷,该方法是物理方法 | |
| B. | 乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以转化成乙醛,乙醇和乙醛都能发生加成反应 | |
| D. |  的结构中只含有羟基和羧基 的结构中只含有羟基和羧基 |
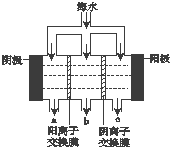 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.