题目内容
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1N |
分析 A.甲基所含有的电子数是9;
B.1个苯乙烯中含有1个碳碳双键;
C.乙烯和丙烯的最简式相同;
D.、C3H6中不一定含有碳碳双键;
解答 解:A.15g甲基的物质的量为$\frac{15g}{15g/mol}$=1mol,故含有的电子数是9×1mol=9mol,即9NA个,故A错误;
B.1mol苯乙烯中含有的碳碳双键数为NA个,故B错误;
C.乙烯和丙烯的最简式都为CH2,故14g乙烯和丙烯含有CH2的物质的量为$\frac{14g}{14g/mol}$=1mol,故含有的原子数为1mol×3=3mol,即3NA个,故C正确;
D.若C3H6为环丙烷,则分子中不含有碳碳双键,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,熟练掌握公式的使用和物质的结构是解题关键,注意有机物结构分析,题目难度不大.

练习册系列答案
相关题目
15.钛是一种用途广泛的活泼金属.工业上常用二氧化钛冶炼金属钛,主要反应有:
①TiO2+2C+2Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4↑+2CO↑,②TiCl4+2Mg $\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti.
下列关于这两个反应的叙述正确的是( )
①TiO2+2C+2Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4↑+2CO↑,②TiCl4+2Mg $\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti.
下列关于这两个反应的叙述正确的是( )
| A. | 均属于置换反应 | B. | 反应①中碳作氧化剂 | ||
| C. | 钛在反应中均被还原 | D. | 反应②说明金属性镁大于钛 |
13.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | Al(OH)3 | B. | Fe(OH)3 | C. | Na2CO3 | D. | AlCl3 |
10.明矾[KAl(SO4)2•12H2O]在生产、生活中有广泛用途:饮用水的净化、食品工业的发酵剂等.利用炼铝厂的废料--铝灰(含Al、Al2O3及少量SiO2和FeO•xFe2O3)可制备明矾.工艺流程如下:
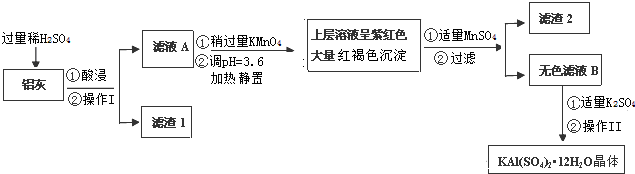
回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1mol•L-1根据表中数据解释调pH=3.6的目的使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀.
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.

回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 7.5 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.
17.用氧化铝为原料制取氢氧化铝最好的方法是( )
| A. | 将氧化铝粉末溶于水 | |
| B. | 将氧化铝粉末溶于盐酸,再滴入氢氧化钠溶液 | |
| C. | 将氧化铝粉末溶于氢氧化钠溶液,再滴加氨水 | |
| D. | 将氧化铝粉末溶于盐酸,再滴入过量的氨水 |
14.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |