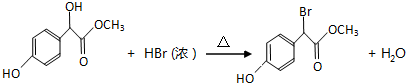题目内容
3. 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,Cu作电池的负极 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故A正确;
B.放电时,锂失电子作负极,Cu上O2得电子作正极,故B错误;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,正极上Cu2O反应,碱性条件下通空气时,铜被氧化表面产生Cu2O,故C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列图示变化表示吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
11.用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1盐酸和HX溶液,溶液的PH随加入NaOH溶液体积变化如图所示.下列说法正确的是( )

| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
8.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
15.部分卤族元素的某种性质A随核电荷数的变化趋势如图所示,则A可能表示( )


| A. | 原子半径 | B. | 氢化物的稳定性 | C. | 电子层数 | D. | 单质的熔沸点 |
13.下列实验中,不能观察到明显现象的是( )
| A. | 把绿豆大的钾投入水中 | |
| B. | 把除去氧化膜的镁带放入少量冷水中 | |
| C. | 把溴水滴加到KI溶液中,并加入少量四氯化碳溶液 | |
| D. | 把铜片和铁片紧靠在一起浸入稀硫酸中 |
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
.
 .
.