题目内容
为了测定某铜银合金的组成,将17.2g合金溶于50mL 11.0mol/L的浓硝酸中,待合金完全溶解后,只生成NO2和NO气体,共4.48L(标准状况),并测得此时溶液中硝酸的物质的量浓度为1.0mol/L.假设反应后溶液的体积仍为50mL.试计算:
(1)被还原的硝酸的物质的量;
(2)合金中银的质量分数.
(1)被还原的硝酸的物质的量;
(2)合金中银的质量分数.
考点:有关混合物反应的计算
专题:计算题
分析:(1)被还有的HNO3生成NO2和NO,根据N原子守恒可知,被还原的n(HNO3)=n(NO2+NO);
(2)计算参加反应的HNO3的物质的量,设合金中铜、银物质的量分别为x、y,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,根据合金质量及N原子守恒列方程,进而计算Ag的质量分数.
(2)计算参加反应的HNO3的物质的量,设合金中铜、银物质的量分别为x、y,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,根据合金质量及N原子守恒列方程,进而计算Ag的质量分数.
解答:
(1)收集到的气体为NO2和NO,故被还原的n(HNO3)=n(NO2+NO)=4.48 L÷22.4L?mol-1=0.20mol,
答:被还原的硝酸的物质的量为0.2mol.
(2)反应的n(HNO3)=11.0 mol?L-1×0.050L-1.0 mol?L-1×0.05L=0.5 mol
设合金中铜、银物质的量分别为x、y,则:
64 g?mol-1?x+108 g?mol-1?y=17.2 g ①
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,据N守恒可得:
2x+y+0.20 mol=0.50 mol ②
解①②得 y=0.10 mol
故合金中银的质量分数=(0.10 mol×108g?mol-1÷17.2g)×100%=62.8%
答:合金中银的质量分数为62.8%.
答:被还原的硝酸的物质的量为0.2mol.
(2)反应的n(HNO3)=11.0 mol?L-1×0.050L-1.0 mol?L-1×0.05L=0.5 mol
设合金中铜、银物质的量分别为x、y,则:
64 g?mol-1?x+108 g?mol-1?y=17.2 g ①
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,据N守恒可得:
2x+y+0.20 mol=0.50 mol ②
解①②得 y=0.10 mol
故合金中银的质量分数=(0.10 mol×108g?mol-1÷17.2g)×100%=62.8%
答:合金中银的质量分数为62.8%.
点评:本题考查混合物计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意守恒思想的应用.

练习册系列答案
相关题目
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、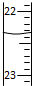 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
不同元素的原子间最本质的区别是( )
| A、中子数不同 |
| B、相对原子质量不同 |
| C、质子数不同 |
| D、最外层电子数不同 |
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是( )
| A、c(HCN)>c(CN-) |
| B、c(Na+)>c(CN-) |
| C、c(HCN)-c(CN-)=c(OH-) |
| D、c(HCN)+c(CN-)=0.1mol/L |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,22.4L N2含有14NA个质子 |
| B、1L 1mol?L-1的盐酸中有NA个Cl- |
| C、标准状况下,36g含有D2O中含有个2NA分子 |
| D、1mol Na被完全氧化生成Na2O2,失去个2NA电子 |
 (1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
 如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:
如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写: 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: