题目内容
1.为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如图实验:
已知,各步反应所需试剂均过量,请回答:
(1)X的化学式为Cu5(OH)4(CO3)3或2Cu(OH)2•3CuCO3.
(2)写出X与稀硫酸反应的离子方程式Cu5(OH)4(CO3)3+10H+=5Cu2++7H2O+3CO2↑.
(3)红色固体B的硫酸盐溶液与纯碱溶液反应能得到X,该反应的化学方程式为5CuSO4+7Na2CO3+4H2O=Cu5(OH)4(CO3)3↓+5Na2SO4+4NaHCO3.
分析 黑色固体高温下能与CO反应生成红色固体B,说明B为Cu,其物质的量为$\frac{3.20g}{64g/mol}$=0.05mol,混合气体1.68g经过无水CaCl2后剩余1.32g,说明混合气体中含H2O的物质的量为$\frac{1.68g-1.32g}{18g/mol}$=0.02mol,气体A1.32g通入Ba(OH)2溶液中得到沉淀5.91g,说明混合气体中含CO2的物质的量为$\frac{5.91g}{197g/mol}$=0.03mol.由此可知,X中含Cu2+0.05mol,含CO32-0.03mol,根据电荷守恒规则,含OH-0.04mol,所以X的化学式为Cu5(OH)4(CO3)3或2Cu(OH)2•3CuCO3.以此解答该题.
解答 解:(1)由以上分析可知X为Cu5(OH)4(CO3)3或2Cu(OH)2•3CuCO3,故答案为:Cu5(OH)4(CO3)3或2Cu(OH)2•3CuCO3;
(2)X与稀硫酸反应的离子方程式为Cu5(OH)4(CO3)3+10H+=5Cu2++7H2O+3CO2↑,故答案为:Cu5(OH)4(CO3)3+10H+=5Cu2++7H2O+3CO2↑;
(3)红色固体B的硫酸盐溶液与纯碱溶液反应能得到X,该反应的化学方程式为5CuSO4+7Na2CO3+4H2O=Cu5(OH)4(CO3)3↓+5Na2SO4+4NaHCO3,
故答案为:5CuSO4+7Na2CO3+4H2O=Cu5(OH)4(CO3)3↓+5Na2SO4+4NaHCO3.
点评 本题考查了无机物推断,为高频考点,侧重考查学生的分析能力和计算能力,熟悉元素化合物的性质是解本题关键,知道流程图中每一步发生的反应及反应现象,题目难度中等.

练习册系列答案
相关题目
11.水蒸气通过炽热的炭层时,发生反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO,该反应类型属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
12.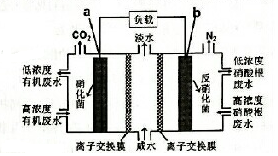 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )| A. | a电极为该电池的正极 | |
| B. | 电极b的反应式:2NO3--10e-+12H+=N2↑+6H2O | |
| C. | 每处理1molC8H10O5,b电极将产生3.2molN2 | |
| D. | a电极离子交换膜允许Na+白中间空迁有机废水处理室 |
16.下列说法不正确的是( )
| A. | 金刚石、石墨、C60互为同素异形体,它们形成的晶体都是分子晶体 | |
| B. | 乙烯、苯分子中所有原子都在同一个平面上 | |
| C. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2)官能团 | |
| D. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 |
6.饮食合理、营养均衡是健康的基本保证.下列食物中,富含糖类的是( )
| A. | 橄榄油 | B. | 蔬菜 | C. | 米饭 | D. | 苹果 |
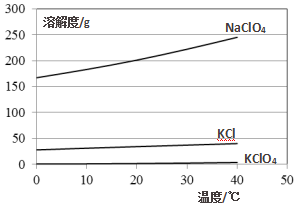 化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:
化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下: