题目内容
5.下列关于化学反应的描述正确的是( )| A. | 铵明矾中加入过量的氢氧化钡溶液的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol | |
| C. | 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ | |
| D. | 将过量SO2通入少量氨水中的离子方程式为:SO2+2NH3•H2O═2NH4++SO32- |
分析 A.漏写铵根离子与碱的反应;
B.只有Cu、I元素的化合价变化,Cu(IO3)2为氧化剂,KI为还原剂;
C.强碱溶液中不能生成氢离子;
D.反应生成亚硫酸氢铵.
解答 解:A.铵明矾中加入过量的氢氧化钡溶液的离子方程式为NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+AlO2-+2H2O+NH3•H2O,故A错误;
B.只有Cu、I元素的化合价变化,Cu(IO3)2为氧化剂,KI为还原剂,其中2molKI不作还原剂,由化学计量数可知,则当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol,故B正确;
C.强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为2ClO-+Fe(OH)2+2OH-═FeO42-+2Cl-+2H2O,故C错误;
D.将过量SO2通入少量氨水中的离子方程式为SO2+NH3•H2O═NH4++HSO3-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应中保留化学式的物质及电子、电荷守恒,注重学生思维严密性的训练,题目难度不大.

练习册系列答案
相关题目
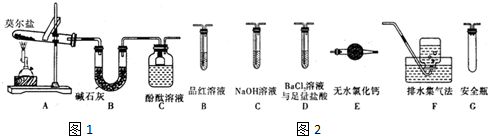
15.利用如图所示装置进行实验,下列说法正确的是( )
| A. | 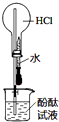 如图实验可观察到红色喷泉 | |
| B. | 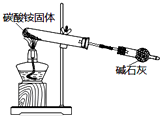 如图实验可制取少量氨气 | |
| C. | 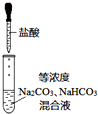 如图实验中逐滴滴加稀盐酸时,试管中立即产生大量气泡 | |
| D. | 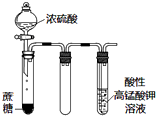 如图实验中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变 |
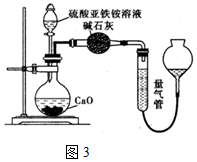
16.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
20.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素.用天青石(主要成分为SrSO4,含有少量BaCO3、FeO、Fe2O3、Al2O3、SiO2等)制备SrCO3,工艺流程如图1:
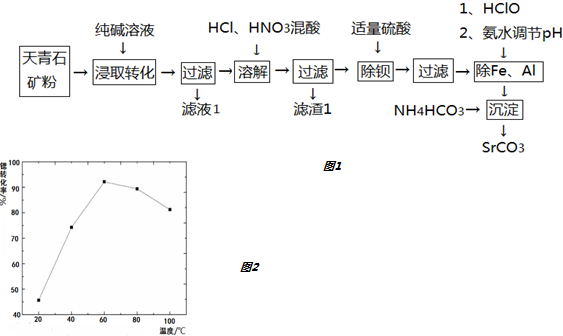
已知:
(1)“浸取转化”过程中发生的化学方程式为:SrSO4+Na2CO3=SrCO3+Na2SO4;当转化完全时,混合液中的c(CO32-)=1.0×10-3 mol•L-1,则c(SO42-)=2.0mol/L.
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.

已知:
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.
17.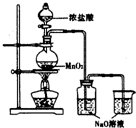 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
15.在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重.这种材料难分解,处理麻烦.最近研制出了一种新材料: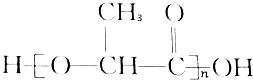 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
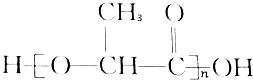 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是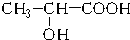 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
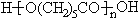 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: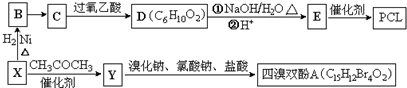
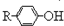 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$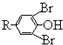
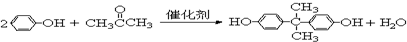 .
.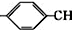 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3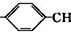 =CHCOOR+2H2O
=CHCOOR+2H2O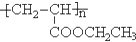 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: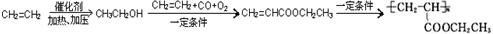 .
.
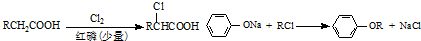
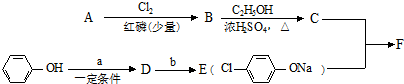
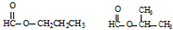 .
.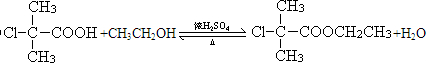 .
.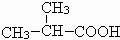 ;F
;F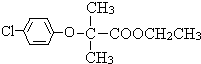 .
.