题目内容
氯气溶于水达到平衡后,下列叙述中正确的是( )
| A、通入少量SO2,溶液的漂白性增强 | ||
| B、加入少量Na2CO3粉末或CaCO3粉末,c(H+)减小,HClO浓度增大 | ||
| C、加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-) | ||
D、再加入少量水,
|
考点:弱电解质在水溶液中的电离平衡,氯气的化学性质
专题:
分析:A、通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,平衡左移,漂白性减弱;
B、C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末或CaCO3粉末,会和溶液中的盐酸反应平衡正向进行;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-),加入少量固体NaOH,溶液呈酸性,只有溶液为中性时c(Na+)=c(Cl-)+c(ClO-);D、氯气与水的反应,加入水,电离平衡向右移动.
B、C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末或CaCO3粉末,会和溶液中的盐酸反应平衡正向进行;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-),加入少量固体NaOH,溶液呈酸性,只有溶液为中性时c(Na+)=c(Cl-)+c(ClO-);D、氯气与水的反应,加入水,电离平衡向右移动.
解答:
解:在氯水中存在如下平衡:Cl2+H2O HCl+HClO、H2O
HCl+HClO、H2O H++OH-、HClO
H++OH-、HClO H++ClO-.
H++ClO-.
A、通入少量SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,平衡左移,HClO的浓度减小,溶液漂白性减弱,故A错误;
B、在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末或CaCO3粉末,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钠反应,c(H+)减小,HClO浓度增大,故B正确;
C、加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),加入少量固体NaOH,溶液呈酸性,则有:c(H+)>c(OH-),所以c(Na+)<c(Cl-)+c(ClO-),故C错误;
D、Cl2+H2O?H++Cl-+HClO,加入少量水,平衡向正反应方向移动,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,
应该相等,但实际上HClO的电离程度增大,使c(ClO-)增大倍数多,所以
应减小,故D错误;
故选B.
 HCl+HClO、H2O
HCl+HClO、H2O H++OH-、HClO
H++OH-、HClO H++ClO-.
H++ClO-.A、通入少量SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,平衡左移,HClO的浓度减小,溶液漂白性减弱,故A错误;
B、在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末或CaCO3粉末,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钠反应,c(H+)减小,HClO浓度增大,故B正确;
C、加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),加入少量固体NaOH,溶液呈酸性,则有:c(H+)>c(OH-),所以c(Na+)<c(Cl-)+c(ClO-),故C错误;
D、Cl2+H2O?H++Cl-+HClO,加入少量水,平衡向正反应方向移动,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,
| c(H +) |
| c(ClO -) |
| c(H +) |
| c(ClO -) |
故选B.
点评:本题既考查了化学平衡,又考查了电离平衡,注意次氯酸是一种弱电解质,在增加HClO时,其电离程度减小,在水中加酸或碱都抑制了水的电离.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质的水溶液在蒸发皿中加热蒸干灼烧,能得到原物质的是( )
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ | B、②③④⑤⑨⑩ |
| C、③⑤⑦⑩ | D、①③⑩ |
如图所示的实验操作中正确的是( )
A、 制取氧气 |
B、 检查装置气密性 |
C、 加入药品 |
D、 除去CO中的CO2 |
“化学是实验的科学,只有实验才是检验理论的标准”.下列关于各实验装置图的叙述中,正确的是( )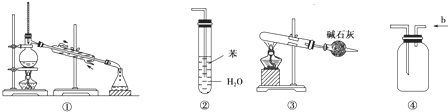

| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
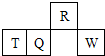 短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )
短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )| A、原子半径的大小:W>Q>R |
| B、气态氢化物的稳定性:R>Q>T |
| C、对应含氧酸的酸性强弱:W>Q>T |
| D、R分别与T、Q、W形成化合物的晶体均为分子晶体 |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|