题目内容
17.某有机物分子组成为C5H8O2,其可与Na2CO3作用放出使澄清石灰水变浑浊的气体,则其可能的链状结构有(不考虑立体异构)( )| A. | 6种 | B. | 5种 | C. | 8种 | D. | 7种 |
分析 能与Na2CO3,溶液反应生成CO2,说明此分子含有羧基,为链状结构,根据H的数目,说明分子中还含有碳碳双键,然后根据官能团的位置异构和碳链异构确定.
解答 解:能与Na2CO3,溶液反应生成CO2,说明此分子含有羧基,为链状结构,根据H的数目,说明分子中还含有碳碳双键,根据碳链异构和双键、羧基官能团异构可得:碳链
8种同分异构体,分别为:
 ,
,
故选D.
点评 本题考查同分异构体的书写,通过性质判定含有的官能团,通过碳链异构和位置异构确定有机物种数.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
7.下列有关说法正确的是( )
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
8.某工厂废水中含有毒的CrO42-和Cr2O72-,常见处理方法是使其转化为毒性较低的Cr3+或直接吸附除去.现有如下几种工艺:
(1)光催化法:在催化剂作用下,利用太阳光和人工光,使废水实现上述转化.
①该法的反应原理是2Cr2O72-+16H+→4Cr3++3O2+8H2O(将方程式补充完整)
②该法涉及的能量转化形式是.
③某小组通过实验研究催化剂中W(钨)和α-Fe2O3的比例对铬的去除率的影响(每次实验均采用:0.01mol/L 500mL酸化的K2Cr2O7溶液、总质量为0.2g的催化剂、光照10min),六价铬的去除率如下表所示.
上表中,b=15%;在去除率最高的催化剂实验组中,用Cr2O72-表示的该反应在10min内的平均化学反应速率v=mol/(L•min).
(2)电化学处理法:向废铁屑(铁碳合金)中加入含铬废水,一段时间后,废水中六价铬元素的去除率能达到90%.
①废铁屑在使用前酸洗除锈的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
②结合电化学原理说明废铁屑在此过程中所起的作用是铁在原电池反应中做负极Fe-2e-=Fe2+,Fe2+做还原剂将六价铬还原.
(3)离子交换树脂(ROH)法:将CrO42-和Cr2O72-吸附至树脂上除去,原理如下:
2ROH+CrO42-→R2CrO4+2OH-、2ROH+Cr2O72-→R2Cr2O7+2OH-
(已知:废水中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O).
控制溶液酸性可以提高树脂对六价铬的去除率,其理由是由原理可知:2ROH~CrO42-~Cr,2ROH~Cr2O72-~2Cr,等量树脂去除Cr2O72-的效率高,因此控制酸性使上述平衡正向移动,使CrO42-转化为Cr2O72-.
(1)光催化法:在催化剂作用下,利用太阳光和人工光,使废水实现上述转化.
①该法的反应原理是2Cr2O72-+16H+→4Cr3++3O2+8H2O(将方程式补充完整)
②该法涉及的能量转化形式是.
③某小组通过实验研究催化剂中W(钨)和α-Fe2O3的比例对铬的去除率的影响(每次实验均采用:0.01mol/L 500mL酸化的K2Cr2O7溶液、总质量为0.2g的催化剂、光照10min),六价铬的去除率如下表所示.
| 催化剂组成 | 1 | 2 | 3 |
| WO3 W α-Fe2O3 | 65% 5% 30% | 65% 10% 25% | a b 20% |
| 六价铬去除率 | 60.2% | 80% | 72.9% |
(2)电化学处理法:向废铁屑(铁碳合金)中加入含铬废水,一段时间后,废水中六价铬元素的去除率能达到90%.
①废铁屑在使用前酸洗除锈的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
②结合电化学原理说明废铁屑在此过程中所起的作用是铁在原电池反应中做负极Fe-2e-=Fe2+,Fe2+做还原剂将六价铬还原.
(3)离子交换树脂(ROH)法:将CrO42-和Cr2O72-吸附至树脂上除去,原理如下:
2ROH+CrO42-→R2CrO4+2OH-、2ROH+Cr2O72-→R2Cr2O7+2OH-
(已知:废水中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O).
控制溶液酸性可以提高树脂对六价铬的去除率,其理由是由原理可知:2ROH~CrO42-~Cr,2ROH~Cr2O72-~2Cr,等量树脂去除Cr2O72-的效率高,因此控制酸性使上述平衡正向移动,使CrO42-转化为Cr2O72-.
5.某学习小组用粗苯甲酸制取高纯度的苯甲酸乙酯.
【查阅资料】
【提纯苯甲酸】
①将粗苯甲酸加到烧杯中,再加入蒸馏水,边加热边搅拌,使粗苯甲酸完全溶解.
②再加入少量蒸馏水并搅拌.
③趁热过滤,静置,冷却结晶.
④滤出晶体.
(1)以上各步中均要用到的玻璃仪器是烧杯、玻璃棒.
(2)已知温度越低,苯甲酸的溶解度越小.为了得到更多的苯甲酸晶体,有同学认为结晶的温度越低越好,你认为是否正确?否(填“是”或“否”),原因是温度过低,杂质可能结晶析出,达不到提纯苯甲酸的目的.
【合成粗产品】
苯甲酸和乙醇在浓硫酸作用下加热反应可得苯甲酸乙酯粗产品.
(3)欲提高苯甲酸的转化率,可以采取的措施是加入过量的乙醇或移去苯甲酸乙酯(任答1点).
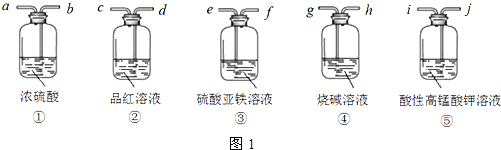
(4)该小组同学认为本实验中可能的气体副产物有乙烯、二氧化硫等,从下列装置中选出必要的装置检验乙烯,正确的连接顺序为:气体副产物→ghdcj(填接口字母编号).
【精制粗产品】
苯甲酸乙酯粗产品中往往含有少量乙醇、硫酸、苯甲酸和水等,精制的流程图如图2:
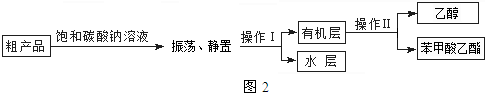
(5)操作Ⅱ的名称是蒸馏.
(6)上述精制过程中饱和碳酸钠溶液的作用是溶解乙醇、除去(或反应)酸性物质、降低酯的溶解度.
【查阅资料】
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
①将粗苯甲酸加到烧杯中,再加入蒸馏水,边加热边搅拌,使粗苯甲酸完全溶解.
②再加入少量蒸馏水并搅拌.
③趁热过滤,静置,冷却结晶.
④滤出晶体.
(1)以上各步中均要用到的玻璃仪器是烧杯、玻璃棒.
(2)已知温度越低,苯甲酸的溶解度越小.为了得到更多的苯甲酸晶体,有同学认为结晶的温度越低越好,你认为是否正确?否(填“是”或“否”),原因是温度过低,杂质可能结晶析出,达不到提纯苯甲酸的目的.
【合成粗产品】
苯甲酸和乙醇在浓硫酸作用下加热反应可得苯甲酸乙酯粗产品.
(3)欲提高苯甲酸的转化率,可以采取的措施是加入过量的乙醇或移去苯甲酸乙酯(任答1点).
(4)该小组同学认为本实验中可能的气体副产物有乙烯、二氧化硫等,从下列装置中选出必要的装置检验乙烯,正确的连接顺序为:气体副产物→ghdcj(填接口字母编号).

【精制粗产品】
苯甲酸乙酯粗产品中往往含有少量乙醇、硫酸、苯甲酸和水等,精制的流程图如图2:

(5)操作Ⅱ的名称是蒸馏.
(6)上述精制过程中饱和碳酸钠溶液的作用是溶解乙醇、除去(或反应)酸性物质、降低酯的溶解度.
12.有下列四组物质,如果把该组某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,白色沉淀质量达到最大值后不溶解”的现象,这组物质是( )
| A. | 硝酸银、氨水 | B. | 硫酸亚铁溶液、氢氧化钠溶液 | ||
| C. | 明矾溶液、氢氧化钡溶液 | D. | 氯化铝溶液、氢氧化钠溶液 |
2.苯佐卡因(对氨基苯甲酸乙酯)为白色粉末,常用于创面、溃疡面及痔疮的镇痛.实验室制备苯佐卡因的反应、装置示意图和有关数据如下:
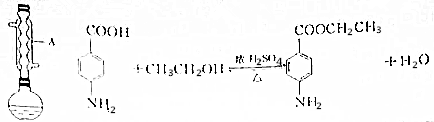
实验步骤:在圆底烧瓶中加入2~3片碎瓷片,0.00300mol对氨基苯甲酸、0.0150mol乙醇和数滴浓硫酸,振荡,然后将烧瓶在水浴上加热回流1h,冷却后,分批加入NaHCO3溶液直至无明显气泡产生,再加入少量NaHCO3溶液至pH≈8.将烧瓶中的液体倒入分液漏斗中,用乙醚分两次萃取,向分液所得的乙醚层中加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,最后蒸馏,蒸出乙醚,得苯佐卡因0.198g.
回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)碎瓷片的作用是防止暴沸.
(3)本实验中加入过量乙醇的目的是提高对氨基苯甲酸的利用率.
(4)加入NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(5)分液漏斗使用之前必须进行的操作是查漏;分液时,应先将下层液从分液漏斗下口放出,再将上层液从上口倒出.
(6)实验中加入少量无水硫酸镁的目的是吸收乙醚中的水.
(7)本实验中苯佐卡因的产率是40%(保留三位有效数字).
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)碎瓷片的作用是防止暴沸.
(3)本实验中加入过量乙醇的目的是提高对氨基苯甲酸的利用率.
(4)加入NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(5)分液漏斗使用之前必须进行的操作是查漏;分液时,应先将下层液从分液漏斗下口放出,再将上层液从上口倒出.
(6)实验中加入少量无水硫酸镁的目的是吸收乙醚中的水.
(7)本实验中苯佐卡因的产率是40%(保留三位有效数字).
9.往氯水中滴入Na2SO3溶液的pH变化如图所示,下列说法正确的是( )
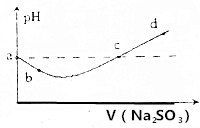

| A. | a点表示的溶液中存在3种分子,3种离子 | |
| B. | b点溶液中不存在SO2 | |
| C. | c点溶液中c(Na+)=2c(HSO3-)+2c(SO32-) | |
| D. | d点溶液中不存在HSO3- |
6.S2Cl2是工业上常用的硫化剂,是一种金黄色液体.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量Cl2制取S2Cl2的装置(部分夹持、加热装置已略去)
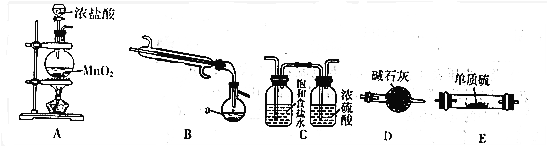
(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.