题目内容
1.已知X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3-具有相同的电子层结构,Y、W原子的价电子数目之和为13.下列有关说法中正确的是( )| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z2Y与ZW中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有化合物均为无色气体 |
分析 X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3-具有相同的电子层结构,则Z位于ⅠA族、X位于ⅤA族,由于X的原子序数最小,则X为N元素,故Z处于第三周期,为Na元素;Y、W原子的价电子数目之和为13,二者的最外层电子数小于8,则Y、W的最外层电子数分别为6、7,则Y为O元素、W为Cl元素.
解答 解:X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3-具有相同的电子层结构,则Z位于ⅠA族、X位于ⅤA族,由于X的原子序数最小,则X为N元素,故Z处于第三周期,为Na元素;Y、W原子的价电子数目之和为13,二者的最外层电子数小于8,则Y、W的最外层电子数分别为6、7,则Y为O元素、W为Cl元素.
A.同一周期中原子序数越大原子半径越小,一般电子层越多原子半径越大,则四种元素的原子半径:Y(O)<X(N)<W(Cl)<Z(Na),故A错误;
B.化合物Na2O含有离子键,NaCl也含有离子键,故B正确;
C.X与W两种元素的最简单氢化物分别为NH3、HCl,二者发生化合反应生成NH4Cl,故C正确;
D.常温下,X和Y形成的所有化合物中NO2为红棕色气体,故D错误.
故选:BC.
点评 本题考查结构性质位置关系应用,侧重考查元素周期律与元素化合物知识的考查,注意抓住短周期主族元素进行推断,题目难度中等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
15.以煤、石油和天然气为原料生产合成材料.下列说法正确的是( )
| A. | 塑料、合成橡胶和合成纤维是三大合成材料 | |
| B. | 在聚乙烯中,-CH2-CH2-称为单体 | |
| C. | 通过加聚反应得到涤纶、环氧树脂、酚醛树脂 | |
| D. | 通过缩聚反应得到聚丙烯、聚甲基丙烯酸甲酯 |
16.下列关于化学反应的自发性叙述中正确的是( )
| A. | △H>0、△S>0的反应肯定是自发的 | B. | △H>0、△S<0的反应肯定是自发的 | ||
| C. | △H<0、△S>0的反应肯定是自发的 | D. | △H<0、△S<0的反应高温时是自发的 |
13.等质量的钠、镁、铝分别与等量的稀硫酸反应,金属均过量,生成的氢气是( )
| A. | 钠最多 | B. | 镁最多 | C. | 铝最多 | D. | 一样多 |
20.${\;}_{72}^{185}$Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途.若一个该核素的质量为ag,一个12C核素的质量为bg,NA表示阿伏加德罗常数的值,下列说法中错误的是( )
| A. | NA=$\frac{12}{b}$ | |
| B. | Wg${\;}_{72}^{185}$Hf的物质的量为$\frac{W}{a{N}_{A}}$mol | |
| C. | ${\;}_{72}^{185}$Hf的摩尔质量为$\frac{2a}{b}$g•mol-1 | |
| D. | 等物质的量的${\;}_{72}^{185}$Hf、12C的质量之比为b:a |
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | 足球烯(C60)在苯中的溶解度大 | 足球烯是原子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
11.将0.20mol•L-1的NH3•H2O溶液和0.10mol•L-1的HCl溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(Cl-)+c(OH-) | ||
| C. | c(NH4+)+c(NH3•H2O)=0.10mol•L-1 | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
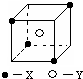 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: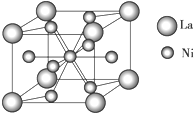 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题: