题目内容
1.某混合溶液中所含离子为NO3-、SO42-、H+、M浓度分别为 2mol•L-1、1mol•L-1、2mol•L-1、1mol•L-1,则M离子可能为( )| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | S2- |
分析 由离子共存可知,M离子不能为Ba2+、S2-,溶液不显电性,则阳离子带的电荷总数等于阴离子带的电荷总数,据此计算离子的电荷进行判断.
解答 解:由于SO42-与Ba2+能结合生成BaSO4沉淀,不能共存,酸性条件下NO3-具有强氧化性,可以氧化S2-,M离子不能为Ba2+、S2-.
设M离子的电荷为x,溶液不显电性,由电荷守恒可知:2mol/L×1+2mol/L×1=1mol/L×2×1mol/L×x,解得x=+2,溶液中M离子为Mg2+,
故选A.
点评 本题考查物质的量浓度的有关计算、离子共存,难度不大,利用电荷守恒确定M所带电荷是关键,属于易错题目,学生容易忽略离子共存问题.

练习册系列答案
相关题目
11.下列有关物质用途的说法,不正确的是( )
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
16.图为用惰性电极电解NaCl溶液制备盐酸和氢氧化钠的装置图,下列说法正确的是( )
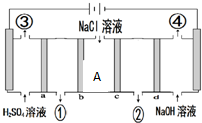

| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
6.下列实验操作中,正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
13.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液.电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色,同时有白色沉淀生成.下列说法中正确的是( )
| A. | 对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 | |
| B. | 对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 | |
| C. | 阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH- 浓度增大,溶液显碱性,从而使酚酞变红 | |
| D. | 阴极上的电极反应式为:Cu2++2e-=Cu |
10.N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第三周期第IVA族.
(2)Cu原子的价层电子排布图为 .
.
(3)基态Fe原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色.
(4)用“>”或“<”填空:
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2 或N2H4(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为+1.
(1)Si位于元素周期表第三周期第IVA族.
(2)Cu原子的价层电子排布图为
 .
.(3)基态Fe原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色.
(4)用“>”或“<”填空:
| 离子半径 | 电负性 | 熔点 | 酸性 |
| O2-> Na+ | F>O | 金刚石> 晶体硅 | H2SO4<HClO4 |
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为+1.

11.下列有机物在空气中燃烧的说法正确的是( )
| A. | 只有碳的氧化物和水 | |
| B. | 只有CO2和水 | |
| C. | 可能有碳的氧化物、水及其他元素的化合物 | |
| D. | 有CO、CO2、水及其他元素的化合物 |
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: