题目内容
9.把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)?nZ(气)+2W(气) 5min末生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L•min)求:
(1)反应中Z气体的计量数n
(2)5分钟末X的物质的量浓度
(3)反应在5分钟末时,Y的转化率.
分析 把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
(1)根据速率计算生成Z的物质的量,进而计算n的值;
(2)根据c=$\frac{n}{V}$计算c(X)
(3)Y的转化率=$\frac{消耗的Y的物质的量}{Y的起始物质的量}$×100%;
解答 解:把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
(1)0.01mol/(L•min)×5min×2L=0.1n mol,解得n=1,
答:n值为1;
(2)根据c=$\frac{n}{V}$可知,c(X)=$\frac{0.3mol}{2L}$=0.15mol/L,
答:5分钟末X的物质的量浓度0.15mol/L;
(3)Y的转化率=$\frac{0.1mol}{0.4mol}$×100%=25%,
答:反应在5分钟末时,Y的转化率为25%.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意对速率定义式的理解与灵活应用.

练习册系列答案
相关题目
19.下列溶液中的Cl-浓度与50mL0.5mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 50 mL 1 mol•L-1 NaCl溶液 | B. | 100 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 1 mol•L-1 CuCl2溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
20.由-CH3、-OH、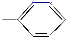 、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )
、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )
 、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )
、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
4.下列说法正确的是( )
| A. | 相同条件下,若1mol氢原子所具有的能量为E1,1mol氢分子具有的能量为E2,则2E1>E2 | |
| B. | 已知4A(g)+5B(g)?4C(g)+6D(g)△H<0,向平衡容器里继续加入A和B,△H会减小 | |
| C. | 浓硫酸用水稀释过程是放热的,所以稀释浓硫酸是一个放热反应. | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
1.某混合溶液中所含离子为NO3-、SO42-、H+、M浓度分别为 2mol•L-1、1mol•L-1、2mol•L-1、1mol•L-1,则M离子可能为( )
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | S2- |
18.某无色透明溶液中,能够大量共存的离子组是( )
| A. | Na+、K+、MnO4-、NO3- | B. | Na+、Ba2+、OH-、CO32- | ||
| C. | Fe2+、H+、SO42-、NO3- | D. | Mg2+、Na+、NO3-、SO42- |
19.用CH4催化还原NOX可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、CO2、H2O(g)放出1042.8kJ的热量,则△H1是( )
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、CO2、H2O(g)放出1042.8kJ的热量,则△H1是( )
| A. | -867kJ•mol-1 | B. | -574kJ•mol-1 | C. | -691.2kJ•mol-1 | D. | -925.6kJ•mol-1 |
 .
.