题目内容
15.下列有关实验的内容正确的是( )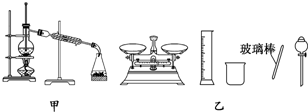
| A. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示 |
分析 A.托盘天平的感量是0.1g,其溶于水得到1L溶液时才能得到0.1mol/L溶液;
B.蒸馏时,温度计测量馏分温度;
C.Na、K能和氧气、水反应;
D.配制一定物质的量浓度的溶液需要容量瓶,不需要分液漏斗.
解答 解:A.托盘天平的精确度为0.1g,不能称量10.600g,且物质的量浓度中的体积是溶液的体积而不是溶剂的体积,故10.600g的碳酸钠溶于水1L水,溶液体积大于1L,所以得不到0.1mol/L的溶液,故A错误;
B.蒸馏时,温度计测量馏分温度,所以温度计水银球位于蒸馏烧瓶支管口处,故B错误;
C.金属钠或钾能与空气中的水或氧气反应,剩余的药品要放回原瓶不存在安全隐患,故C正确;
D.配制500mL 0.4mol•L-1 NaCl溶液需要用到的仪器有量筒、烧杯、玻璃棒、容量瓶、胶头滴管,故D错误;
故选C.
点评 本题考查了实验方案评价,明确实验基本操作原理即可解答,知道常见仪器的用途、实验室安全规则等知识点,易错选项是C,很多剩余化学药品不能放回原瓶,但K、Na除外.

练习册系列答案
相关题目
6.下列物质属于纯净物的是( )
| A. | 钢 | B. | 液氯 | C. | 玻璃 | D. | 氨水 |
3.下列有关化合物的说法正确的是( )
| A. | 干冰的主要成分是H2O | B. | 吸入CO可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | 小苏打的主要成份是Na2CO3 |
10.${\;}_{53}^{131}$I可用于治疗甲亢,有关${\;}_{53}^{131}$I的说法正确的是( )
| A. | 中子数为131 | B. | 质子数为131 | C. | 质量数53 | D. | 电子数53 |
20.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,VL水含有的氧原子个数为$\frac{V}{22.4}$NA | |
| B. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44个 | |
| C. | 常温下,1L 1 mol•L-1的乙酸溶液中,所含CH3COO-为NA | |
| D. | 常温常压下,0.1 mol氖气含有的电子数为NA |
7.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为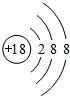 .
.
(2)表中能形成两性氢氧化物的元素在周期表中的位置是第三周期第ⅢA族,写出该元素的最高价氧化物对应的水化物与⑨最高价氧化物的水化物反应的化学方程式KOH+Al(OH)3═KAlO2+2H2O.
(3)用电子式表示④元素与⑦元素形成化合物的过程 .
.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填酸的化学式).
(5)④⑤两元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
(6)⑥和⑦阴离子还原性较强的是(填微粒符号):S2-用一个置换反应证实这一结论(写化学方程式)Cl2+Na2S═2NaCl+S↓
(7)③⑦⑩三种元素的气态氢化物沸点由高到低的顺序为HF>HBr>HCl(写化学式),氢化物酸性由弱到强的顺序为HF<HCl<HBr(写化学式)
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素在周期表中的位置是第三周期第ⅢA族,写出该元素的最高价氧化物对应的水化物与⑨最高价氧化物的水化物反应的化学方程式KOH+Al(OH)3═KAlO2+2H2O.
(3)用电子式表示④元素与⑦元素形成化合物的过程
 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填酸的化学式).
(5)④⑤两元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
(6)⑥和⑦阴离子还原性较强的是(填微粒符号):S2-用一个置换反应证实这一结论(写化学方程式)Cl2+Na2S═2NaCl+S↓
(7)③⑦⑩三种元素的气态氢化物沸点由高到低的顺序为HF>HBr>HCl(写化学式),氢化物酸性由弱到强的顺序为HF<HCl<HBr(写化学式)
4.下列事实中,与电化学腐蚀无关的是( )
| A. | 埋在潮湿土壤里的铁管比在干燥土壤中的更易被腐蚀 | |
| B. | 在空气中,金属镁、铝的表面可形成一层氧化膜 | |
| C. | 为保护海轮的船壳,常在海轮上镶嵌锌块 | |
| D. | 镀锡的铁制品,镀层部分破坏后,露出的铁表面更容易被腐蚀 |
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 苯酚遇石蕊显红色 | B. | 包装用材料聚氯乙烯属于烃 | ||
| C. | 食用花生油能发生水解反应 | D. | PX项目中的对二甲苯属于饱和烃 |
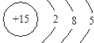 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.