题目内容
10.${\;}_{53}^{131}$I可用于治疗甲亢,有关${\;}_{53}^{131}$I的说法正确的是( )| A. | 中子数为131 | B. | 质子数为131 | C. | 质量数53 | D. | 电子数53 |
分析 根据原子符号中左下角数字为质子数,左上角数字为质量数,中子数=质量数-质子数,核外电子数=核内质子数.
解答 解:53131I的质子数为53,电子数为53,质量数为131,中子数=质量数-质子数=131-53=78,
故选D.
点评 本题主要考查了原子符号的含义以及粒子数目之间的关系,题目难度不大,侧重于基础知识的考查,注意知识的积累.

练习册系列答案
相关题目
20.工业上获得乙烯和丙烯的方法是( )
| A. | 石油分馏 | B. | 煤的干馏 | C. | 石蜡催化裂化 | D. | 重油裂解 |
1.某烷烃含有100个氢原子,那么该烃的分子式是( )
| A. | C47H100 | B. | C48H100 | C. | C49H100 | D. | C50H100 |
18.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕.下列有关镁和铝的说法正确的是( )
| A. | 镁的金属性比铝弱 | |
| B. | 镁和铝的氧化物都可以与盐酸反应 | |
| C. | 镁和铝原子的最外层电子数都为3 | |
| D. | 镁和铝的氧化物都可以与氢氧化钠溶液反应 |
5.下列有关乙酸和乙醇的叙述正确的是( )
| A. | 白醋的醋味源于乙醇 | B. | 米酒主要成分为乙酸 | ||
| C. | 二者均为无机物 | D. | 二者在一定条件下可发生反应 |
15.下列有关实验的内容正确的是( )
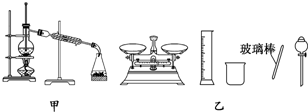

| A. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示 |
2.25℃时,pH=2某酸(HA)与pH=12某碱(BOH)等体积混合后,混合液的pH=10,下列描述中正确的是( )
| A. | 若两者中有一种为强电解质,则一定是BOH | |
| B. | 若HA是强酸,混合液中离子浓度关系一定是C(A-)>C(B+)>C(HO-)>C(H+) | |
| C. | 若混合液中存在离子水解,则一定是A-水解 | |
| D. | 两者混合后,BOH有可能过量 |
19.下面是对铜及其化合物相关性质的研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu;
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)碘化亚铜可作催化剂,饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,试从离子浓度对离子反应方向影响的角度解释此反应能够发生的原因由于CuI难溶于水,使得生成物中的离子浓度减小有利于反应向右进行,CuSO4溶液也能使淀粉-KI试纸变蓝,用离子方程式说明其原理2Cu2++4I-=2CuI↓+I2.
(3)纳米氧化亚铜是一种具有良好光电效应的材料,工业上制备它的方法之一是:先向KOH溶液中加入一定量的CuSO4溶液,再加入一定量的肼(N2H4),加热并保持反应体系的温度在90℃,反应完全后,分离、洗涤、真空干燥所得到的固体样品.
①检验反应混合体系内纳米Cu2O已经生成的实验方法的名称是丁达尔效应,干燥时要“真空”的原因是Cu2O具有还原性,干燥时能被空气中的氧气氧化.
②完成下面的反应方程式:
4CuSO4+1N2H4+8KOH$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+N2+K2SO4+6H2O.
(4)由Cu2O和Cu组成的混合物的质量为1.76g,与足量的稀硝酸充分反应后得到标准状况下的NO气体224mL,则混合物中Cu2O的质量分数为81.8%(保留小数点后1位).
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |  |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu;
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)碘化亚铜可作催化剂,饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,试从离子浓度对离子反应方向影响的角度解释此反应能够发生的原因由于CuI难溶于水,使得生成物中的离子浓度减小有利于反应向右进行,CuSO4溶液也能使淀粉-KI试纸变蓝,用离子方程式说明其原理2Cu2++4I-=2CuI↓+I2.
(3)纳米氧化亚铜是一种具有良好光电效应的材料,工业上制备它的方法之一是:先向KOH溶液中加入一定量的CuSO4溶液,再加入一定量的肼(N2H4),加热并保持反应体系的温度在90℃,反应完全后,分离、洗涤、真空干燥所得到的固体样品.
①检验反应混合体系内纳米Cu2O已经生成的实验方法的名称是丁达尔效应,干燥时要“真空”的原因是Cu2O具有还原性,干燥时能被空气中的氧气氧化.
②完成下面的反应方程式:
4CuSO4+1N2H4+8KOH$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+N2+K2SO4+6H2O.
(4)由Cu2O和Cu组成的混合物的质量为1.76g,与足量的稀硝酸充分反应后得到标准状况下的NO气体224mL,则混合物中Cu2O的质量分数为81.8%(保留小数点后1位).
20.下列鉴别物质的方法能达到目的是( )
| A. | 用加热灼烧的方法鉴别铁粉和炭粉 | |
| B. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 | |
| C. | 用丁达尔效应鉴别FeCl2溶液和FeCl3溶液 | |
| D. | 用氨水鉴别MgSO4溶液和Al2(SO4)3溶液 |