题目内容
20.分别向四份等质量足量的饱和NaOH 溶液中加入等物质的量的Na、Na2O、Na2O2、NaOH固体,充分反应后恢复到原温度,下列关于反应后溶液的说法中正确的是( )| A. | 溶液的质量仍然相等 | B. | 溶质的质量仍然相等 | ||
| C. | 溶剂的质量仍然相等 | D. | 溶液的密度仍然相等 |
分析 根据2Na+2H2O=2NaOH+H2,Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2,可知等物质的量的Na、Na2O、Na2O2消耗的水一样多,析出NaOH的质量相等,而NaOH与H2O不反应,溶液中溶质、溶剂质量不变.
解答 解:等质量足量的饱和NaOH 溶液中加入等物质的量的Na、Na2O、Na2O2、NaOH固体,根据2Na+2H2O=2NaOH+H2,Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2,可知等物质的量的Na、Na2O、Na2O2消耗的水一样多,则恢复到原温度析出NaOH的质量相等,剩余溶液为饱和溶液,则三者反应后溶液质量相等、溶质质量相等、溶剂质量相等、溶液密度不变,而NaOH与H2O不反应且不溶解,则溶液质量、溶质质量、溶剂质量比前三者大,相同温度下饱和溶液的密度相等,故选:D.
点评 本题考查化学方程式计算以及对饱和溶液与溶解度的理解,关键是根据方程式判断消耗水的质量相等.

练习册系列答案
相关题目
7.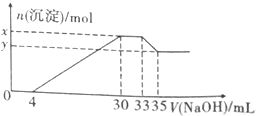 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
5.在pH=1的无色透明溶液中,能大量共存的离子组是( )
| A. | Al3+、Ag+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | Cu2+、Cl-、NO3-、Cl- | D. | K+、Na+、ClO-、S2- |
9.甲醇燃料电池可使用于笔记本电脑、汽车等,它一极通入甲醇,电解质是质子交换膜,它能传导氢离子.电池工作时,甲醇被氧化为二氧化碳和水.下列叙述中,不正确的是( )
| A. | 电池的总反应是2CH3OH+3O2═2CO2+4H2O | |
| B. | 负极的反应是CH3OH+H2O→CO2+6H++6e- | |
| C. | 正极的反应是O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,H+移向正极 |
10.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的物质的量比乙的物质的量少 |
 .
.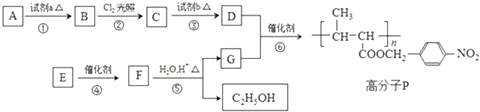
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$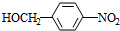 +NaCl.
+NaCl.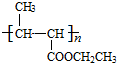 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$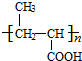 +n CH3CH2OH.
+n CH3CH2OH.