题目内容
4.NA代表阿伏伽德罗常数的数值.下列有关叙述正确的是( )| A. | 常温常压下,4.6gHCOOH和C2H5OH的混合物的分子总数为0.1NA | |
| B. | 标准状况下,11.2LNO和O2的混合气体含有的原子总数为1.5NA | |
| C. | 2L0.5mol/L的AlCl3溶液中,含有离子总数为4NA | |
| D. | 常温下,56gFe与足量的浓硝酸反应,转移电子数为3NA |
分析 A.HCOOH和C2H5OH相对分子质量都是46,依据n=$\frac{m}{M}$计算解答;
B.体积转化为物质的量结合一氧化氮和氧气都是双原子分子;
C.铝离子为弱碱阳离子,水解生成氢氧化铝和氢离子;
D.常温下铁与浓硝酸发生钝化现象,阻止了反应的继续进行.
解答 解:A.4.6gHCOOH和C2H5OH的混合物物质的量为$\frac{4.6g}{46g/mol}$=0.1mol,含有分子总数为0.1NA,故A正确;
B.标准状况下,11.2LNO和O2的混合气体物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有的原子总物质的量为0.5mol×2=1mol,原子总数为1NA,故B错误;
C.2L0.5mol/L的AlCl3溶液中,铝离子为弱碱阳离子,1mol铝离子水解生成1mol氢氧化铝和3mol氢离子,含有离子总数为4NA,故C错误;
D.在常温下铁与浓硫酸、浓硝酸发生钝化,无法计算转移的电子数,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的综合应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意铁与浓硝酸常温下发生钝化,题目难度中等.

练习册系列答案
相关题目
15.下列能说明氯元素原子得电子能力比硫强的是( )
①HCl的溶解度比H2S大②HCl的酸性比H2S强③HCl的稳定性比H2S强④HCl的还原性比H2S强⑤HClO的酸性比H2SO4强⑥Cl2能与H2S反应生成S⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS⑧还原性:Cl-<S2-.
①HCl的溶解度比H2S大②HCl的酸性比H2S强③HCl的稳定性比H2S强④HCl的还原性比H2S强⑤HClO的酸性比H2SO4强⑥Cl2能与H2S反应生成S⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS⑧还原性:Cl-<S2-.
| A. | ③④⑤⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ②④⑤⑥⑦⑧ |
12.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1L0.1mol•L-1的Ba(OH)2溶液稀释为2L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
19.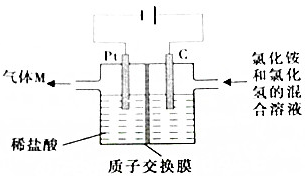 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
16.下列说法中正确的是( )
| A. | 碘酒是指单质碘的乙醇溶液 | |
| B. | 化合反应均为氧化还原反应 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
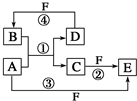 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).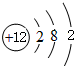 ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.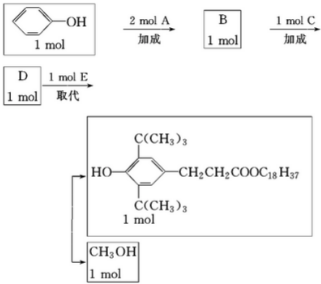
 +
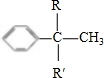
+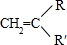 →
→
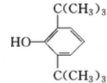 ,C:CH2=CHCOOCH3,D:
,C:CH2=CHCOOCH3,D: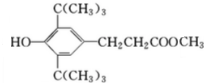 ,E:C18H37OH.
,E:C18H37OH. 属醇类化合物(填“醇”或“酚”)
属醇类化合物(填“醇”或“酚”) B.
B.
 D.
D. E.
E.