题目内容
15.下列能说明氯元素原子得电子能力比硫强的是( )①HCl的溶解度比H2S大②HCl的酸性比H2S强③HCl的稳定性比H2S强④HCl的还原性比H2S强⑤HClO的酸性比H2SO4强⑥Cl2能与H2S反应生成S⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS⑧还原性:Cl-<S2-.
| A. | ③④⑤⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ②④⑤⑥⑦⑧ |
分析 元素的非金属性越强,其得电子能力越强,氯元素原子得电子能力比硫强,说明Cl元素的非金属性比S元素强,可以根据其氢化物的稳定性、其单质的氧化性、其单质与氢气化合难易程度、其最高价氧化物的水化物酸性强弱判断,据此分析解答.
解答 解:元素的非金属性越强,其得电子能力越强,氯元素原子得电子能力比硫强,说明Cl元素的非金属性比S元素强,
①HCl的溶解度比H2S大与其非金属性强弱无关,故错误;
②HCl的酸性比H2S强,说明HCl电离程度大于硫化氢,与其非金属性强弱无关,故错误;
③元素的非金属性越强,其氢化物的稳定性越强,HCl的稳定性比H2S强,说明Cl元素得电子能力大于S,故正确;
④元素的非金属性越强,其简单阴离子的还原性越弱,HCl的还原性比H2S弱,故错误;
⑤HClO的酸性较弱,硫酸是强酸,所以次氯酸的酸性比H2SO4弱,故错误;
⑥Cl2能与H2S反应生成S,说明氯气氧化性大于S,则得电子能力Cl大于S,故正确;
⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明氯气氧化性大于S,则得电子能力Cl大于S,故正确;
⑧元素的非金属性越强,其简单阴离子的还原性越弱,还原性:Cl-<S2-,说明非金属性Cl>S,则得电子能力Cl>S,故正确;
故选C.
点评 本题考查非金属性强弱判断方法,为高频考点,侧重考查学生对知识的灵活运用能力,非金属性强弱与得电子多少无关,与得电子难易程度有关,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
5.用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
(1)用FeCl3酸性溶液脱除H2S的离子方程式为2Fe3++H2S═S↓+2Fe2++2H+
(2)用KSCN检验出Fe3+的离子方程式为Fe3++3SCN-═Fe(SCN)3.
(3)Ⅰ中,Fe3+产生的原因可能是:Cl-在阳极放电(或Cl-失电子生成Cl2),生成的Cl2将Fe2+氧化.
(4)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(5)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl的浓度是0.2mol/L
②Ⅳ中检测Cl2的实验方法湿润的淀粉碘化钾检验生成气体,试纸变蓝.
③与Ⅱ对比,得出的结论(写出两点):通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)用KSCN检验出Fe3+的离子方程式为Fe3++3SCN-═Fe(SCN)3.
(3)Ⅰ中,Fe3+产生的原因可能是:Cl-在阳极放电(或Cl-失电子生成Cl2),生成的Cl2将Fe2+氧化.
(4)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(5)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检测Cl2的实验方法湿润的淀粉碘化钾检验生成气体,试纸变蓝.
③与Ⅱ对比,得出的结论(写出两点):通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
6.某烃的结构简式为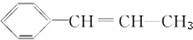 ,它可能具有的性质是( )
,它可能具有的性质是( )
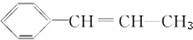 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水也易溶于有机溶剂 | |
| B. | 能发生加聚反应,其生成物可用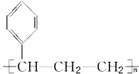 表示 表示 | |
| C. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
3.下列有机物中,能在一定条件下发生消去反应且生成的烯烃只有一种的是( )
| A. |  | B. |  | C. | CH3OH | D. |  |
10.已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
7.硝酸在反应中只表现强氧化性的反应是( )
| A. | C与浓HNO3反应 | B. | Cu与浓HNO3反应 | C. | Cu与稀HNO3反应 | D. | Mg(OH)2与HNO3反应 |
4.NA代表阿伏伽德罗常数的数值.下列有关叙述正确的是( )
| A. | 常温常压下,4.6gHCOOH和C2H5OH的混合物的分子总数为0.1NA | |
| B. | 标准状况下,11.2LNO和O2的混合气体含有的原子总数为1.5NA | |
| C. | 2L0.5mol/L的AlCl3溶液中,含有离子总数为4NA | |
| D. | 常温下,56gFe与足量的浓硝酸反应,转移电子数为3NA |
9.已知NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 2gH2的分子数为NA | |
| B. | 标准状况下,22.4LH2O含有NA个水分子 | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 1mol/LMg(NO3)2溶液中含有NO3-的数目为2NA |
