题目内容
已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大.X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素.
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) .
(2)Z在元素周期表中的位置为 .
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) .
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) .
(5)M2Z的电子式为 .MX与水反应可放出气体,该反应的化学方程式为 .
(6)常温下,不能与G的单质发生反应的是(填序号) .
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) .
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)
(2)Z在元素周期表中的位置为
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)
(5)M2Z的电子式为
(6)常温下,不能与G的单质发生反应的是(填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大.Z、G分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、G为Al元素;Y的原子最外层电子数是其电子层数的2倍,原子序数小于O,只能处于第二周期,最外层电子数为4,则Y为C元素;X单质在常温下呈气态,则X为H元素,X与M同主族,原子序数大于O,则M为Na;Q单质常温下为气态,原子序数大于Al,则Q为Cl,据此解答.
解答:
解:X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大.Z、G分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、G为Al元素;Y的原子最外层电子数是其电子层数的2倍,原子序数小于O,只能处于第二周期,最外层电子数为4,则Y为C元素;X单质在常温下呈气态,则X为H元素,X与M同主族,原子序数大于O,则M为Na;Q单质常温下为气态,原子序数大于Al,则Q为Cl,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径减小,故原子半径Na>Al>C>O,
故答案为:Na>Al>C>O;
(2)Z为O元素,在元素周期表中的位置为第二周期ⅥA族,故答案为:第二周期ⅥA族;
(3)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)H与C能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是C2H2,在实验室中,制取该物质的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:C2H2;CaC2+2H2O→Ca(OH)2+C2H2↑;
(5)Na2O的电子式为 ,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑,
,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑,
故答案为: ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
(6)常温下,Al与硫酸铜溶液反应置换铜,与浓硫酸反应生成致密的氧化物保护膜,发生钝化现象,与氢氧化钠溶液反应生成偏铝酸钠与氢气,不能与氧化铁、碳酸钠反应;
工业上用电解法制Al的单质的化学方程式是2Al2O3(熔融)
4Al+3O2↑,若以石墨为电极,阳极产生的氧气与碳反应生成二氧化碳或CO,故阳极的混合气体的成分是O2、CO2等,
故答案为:be;2Al2O3(熔融)
4Al+3O2↑;O2、CO2等.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径减小,故原子半径Na>Al>C>O,
故答案为:Na>Al>C>O;
(2)Z为O元素,在元素周期表中的位置为第二周期ⅥA族,故答案为:第二周期ⅥA族;
(3)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)H与C能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是C2H2,在实验室中,制取该物质的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:C2H2;CaC2+2H2O→Ca(OH)2+C2H2↑;
(5)Na2O的电子式为
 ,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑,
,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑,故答案为:
 ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;(6)常温下,Al与硫酸铜溶液反应置换铜,与浓硫酸反应生成致密的氧化物保护膜,发生钝化现象,与氢氧化钠溶液反应生成偏铝酸钠与氢气,不能与氧化铁、碳酸钠反应;
工业上用电解法制Al的单质的化学方程式是2Al2O3(熔融)
| ||
| 冰晶石 |
故答案为:be;2Al2O3(熔融)
| ||
| 冰晶石 |
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,(6)注意Al与各物质的反应,学生容易把钝化现象理解为不反应,为易错点,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
①非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
②由不同原子组成的纯净物一定是化合物;
③含金属元素的离子不一定都是阳离子;
④一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路;
⑤胆矾是纯净物,水泥是混合物.
①非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
②由不同原子组成的纯净物一定是化合物;
③含金属元素的离子不一定都是阳离子;
④一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路;
⑤胆矾是纯净物,水泥是混合物.
| A、①③④ | B、③④⑤ |
| C、②③④ | D、①②⑤ |
下列说法正确的是( )
| A、物质的量是一个基本物理量,表示物质所含粒子的多少 |
| B、1mol氢中含有2mol氢原子和2mol电子 |
| C、1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) |
| D、摩尔表示物质的量的数量单位 |
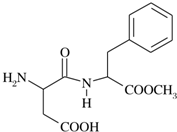 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
 所含官能团的名称是
所含官能团的名称是