题目内容
用双线桥表示电子转移:
(1)H2S+H2SO4(浓)═S↓+SO2+2H2O;
(2)3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O;
(3)2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+19CO2+8H2O;
(4)2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
(1)H2S+H2SO4(浓)═S↓+SO2+2H2O;
(2)3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O;
(3)2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+19CO2+8H2O;
(4)2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
考点:氧化还原反应的电子转移数目计算
专题:
分析:氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,据此分析.
解答:
解:(1)反应过程中H2S中-2价的硫失去2个电子化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子,所以用双线桥表示为
故答案为: .
.
(2)反应3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O中,Fe元素的化合价升高失去3个电子,HNO3中N元素的化合价降低得到3个电子,所以用双线桥表示为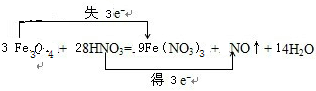 ;
;
故答案为: ;
;
(3)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O中KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,反应中KMnO4为氧化剂,H2C2O4为还原剂,用双线桥法表示下列反应中电子转移的方向和数目可表示为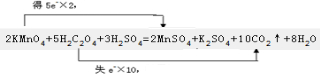 ,故答案为:
,故答案为: ;
;
(4)KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-,则双线桥表示反应中电子转移的方向和数目
为 ,故答案为:
,故答案为: .
.

故答案为:
 .
.(2)反应3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O中,Fe元素的化合价升高失去3个电子,HNO3中N元素的化合价降低得到3个电子,所以用双线桥表示为
 ;
;故答案为:
 ;
;(3)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O中KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,反应中KMnO4为氧化剂,H2C2O4为还原剂,用双线桥法表示下列反应中电子转移的方向和数目可表示为
 ,故答案为:
,故答案为: ;
;(4)KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-,则双线桥表示反应中电子转移的方向和数目
为
 ,故答案为:
,故答案为: .
.
点评:本题考查氧化还原反应,熟悉元素的化合价变化及反应中转移电子数的计算即可解答,题目难度不大.

练习册系列答案
相关题目
已知下列三组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③取实验②中生成的溶液滴在淀粉KI试纸上,试纸变蓝色.则下列判断不正确的是( )
| A、实验①能够证明Cl-具有还原性 |
| B、上述实验不能证明Fe2+具有氧化性 |
| C、上述实验能够证明氧化性:MnO4->Cl2>Fe3+>I2 |
| D、由上述实验不能判断氯气能使湿润的淀粉KI试纸变蓝 |
下列有关实验的说法正确的是( )
| A、中和滴定实验时,用待测液润洗锥形瓶 |
| B、盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶 |
| C、在用PH试纸测溶液的pH值时,用镊子夹取试纸伸到试剂瓶中取液,将颜色与标准比色卡对照,读出数值 |
| D、向纯碱溶液加入酚酞,溶液显红色,将该溶液加热,则红色加深 |
在密闭容中发生下列反应aA(g)?cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的2.2倍,下列叙述正确的是( )
| A、A的转化率变小 |
| B、平衡向逆反应方向移动 |
| C、D的质量百分数变大 |
| D、a<c+d |