题目内容
下列反应的离子方程式书写正确的是( )
| A、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| B、氢氧化钡溶液与稀 H2SO4:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| C、向氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
| D、过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A、氨水是弱酸,应写成化学式;
B、相关离子要符合组成之比;
C、氯气和亚铁离子发生氧化还原反应;
D、亚铁离子和溴离子要符合组成之比.
B、相关离子要符合组成之比;
C、氯气和亚铁离子发生氧化还原反应;
D、亚铁离子和溴离子要符合组成之比.
解答:
解:A、氨水是弱酸,应写成化学式,正确的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故A错误;
B、相关离子要符合组成之比,正确的离子方程式为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故B错误;
C、氯气和亚铁离子发生氧化还原反应,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D、亚铁离子和溴离子要符合组成之比,离子方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,故D错误;
故选C.
B、相关离子要符合组成之比,正确的离子方程式为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故B错误;
C、氯气和亚铁离子发生氧化还原反应,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D、亚铁离子和溴离子要符合组成之比,离子方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,故D错误;
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
在19世纪,化学家对氧化锆的化学式有争议.经测定,锆的相对原子质量为91,其氯化物的相对分子质量是230.若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为( )
| A、ZrO2 |
| B、Zr2O |
| C、Zr2O3 |
| D、ZrO |
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
| A、用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等) |
| B、放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等 |
| C、手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收 |
| D、目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放 |
下面是一些常见分子的比例模型.其中1个分子中只含有2对共用电子对的是( )
A、 氯分子 |
B、 氨分子 |
C、 水分子 |
D、 二氧化碳分子 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L CCl4含有C-Cl键的数目为4NA | ||||
| B、常温常压下,44g 由N2O与CO2组成的混合气体含有的氧原子数目为NA | ||||
C、反应NH4N3
| ||||
| D、1L 1mol?L-1的AlCl3溶液中含有Cl-的数目为3NA |
下列各组中的两个反应,可用同一离子方程式表示的是( )
| A、CaCO3和HCl、Na2CO3和HCl |
| B、BaCl2和H2SO4、Ba(OH)2和H2SO4 |
| C、HNO3和K2CO3、HCl和NaHCO3 |
| D、KOH和H2SO4、Ba(OH)2和HNO3 |
关于钠元素的单质及其化合物的叙述不正确的是( )
| A、钠:银白色,质软,熔点低,密度比水小 |
| B、钠着火时可以用沙子盖灭,少量的钠可保存在煤油中 |
| C、金属钠在空气中长期放置,最终变为碳酸钠 |
| D、氧化钠和过氧化钠都是白色固体,都是碱性氧化物 |
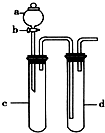 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.