题目内容
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )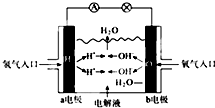

| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |
考点:原电池和电解池的工作原理
专题:
分析:氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;当电解质溶液是氢氧化钾时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;当电解质溶液是酸时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水.
解答:
解:A.燃料电池中,通入燃料氢气的电极a是负极,所以a电极是负极,故A正确;
B.b电极为正极,正极上得电子发生还原反应,O2+4e-+2H2O═4OH-,故B正确;
C.氢氧燃料电池中,溶液中阴离子向负极移动,阳离子向正极移动,故C错误;
D.氢氧燃料电池工作时,发生氧化还原反应,将化学能转化为电能,故D正确;
故选C.
B.b电极为正极,正极上得电子发生还原反应,O2+4e-+2H2O═4OH-,故B正确;
C.氢氧燃料电池中,溶液中阴离子向负极移动,阳离子向正极移动,故C错误;
D.氢氧燃料电池工作时,发生氧化还原反应,将化学能转化为电能,故D正确;
故选C.
点评:本题考查了燃料电池,注意把握原电池原理和电极方程式的书写,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
下列各组物质,属于电解质是( )
| A、熔融NaCl | B、铜 |
| C、酒精 | D、硫酸溶液 |
1gN2O含a个分子,则阿伏加德罗常数可表示为( )
A、
| ||
| B、a mol-1 | ||
| C、44a mol-1 | ||
D、
|
下列叙述不正确的是( )
| A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C、为保护海轮的船壳,常在船壳外面镶上锌块 |
| D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应是相同的 |
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下反应:下列说法中正确的是( )
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH.
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH.
| A、Fe3O4既可看做是氧化物,又可看做是铁盐 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
下列关于
Ne和
Ne的说法正确的是( )
| ||
| 10 |
| ||
| 10 |
| A、质子数相等 | B、质量数相等 |
| C、中子数相等 | D、性质相同 |
下列叙述正确的是( )
| A、电解NaCl溶液时,阴极产生1 mol Cl2的同时阳极产生l molH2 |
| B、0.1 mol?L-1AlCl3溶液中Al3+的浓度为0.1 mol?L-1 |
| C、7 g 14C中所含中子数为4 NA(设NA为阿伏加德罗常数的值) |
| D、2.24 L氯气与足量NaOH稀溶液反应,转移0.1 mol电子 |

 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答: