题目内容
下列叙述不正确的是( )
| A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C、为保护海轮的船壳,常在船壳外面镶上锌块 |
| D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应是相同的 |
考点:金属的电化学腐蚀与防护,化学反应速率的影响因素
专题:
分析:A、根据原电池能加速负极金属和电解质的反应速率来回答;
B、在原电池中,活泼金属做负极,负极金属更易腐蚀,正极金属被保护;
C、金属铁和锌形成的原电池中,金属锌是负极,铁被保护;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应.
B、在原电池中,活泼金属做负极,负极金属更易腐蚀,正极金属被保护;
C、金属铁和锌形成的原电池中,金属锌是负极,铁被保护;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应.
解答:
解:A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜,金属铁会和硫酸铜之间反应生成金属铜和硫酸亚铁,金属铁、铜形成的原电池,能加速负极金属铁和电极质硫酸的反应速率,故A正确;
B、白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故B错误;
C、为保护海轮的船壳,常在船壳外面镶上锌块,这样,金属铁和锌形成的原电池中,金属锌是负极,金属铁是正极,铁被保护,故C正确;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应,正极上分别是氧气得电子的还原反应、氢离子得电子的还原反应,故D正确.
故选B.
B、白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故B错误;
C、为保护海轮的船壳,常在船壳外面镶上锌块,这样,金属铁和锌形成的原电池中,金属锌是负极,金属铁是正极,铁被保护,故C正确;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应,正极上分别是氧气得电子的还原反应、氢离子得电子的还原反应,故D正确.
故选B.
点评:本题是一道综合知识题目,考查学生对原电池原理的应用知识,可以根据所学知识进行回答,注意原电池原理的应用是解题的关键,难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
苯与乙烯相比较,下列叙述不正确的是( )
| A、都是平面结构 |
| B、都能与溴水发生反应 |
| C、在一定条件下都能与H2发生加成反应 |
| D、都能在空气中燃烧 |
下列说法不正确的是( )
| A、浓度均为0.1mol?L-1的醋酸和醋酸钠溶液等体积混合后:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、室温下,浓度均为0.1mol?L-1的盐酸和醋酸溶液,pH前者小于后者 |
| C、等体积的0.1mol?L-1的某一元酸HA与0.1mol?L-1的NaOH溶液恰好完全反应,说明HA是强酸 |
| D、电解饱和食盐水,当阴极在标准状况下产生2.24L氢气时,转移的电子数为0.2NA |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、常温常压下,分子总数为NA的N2和O2的混合气体占有的体积为22.4L |
| D、若1 molCl2所占体积为22.4L,则其所处状况一定为标准状况 |
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )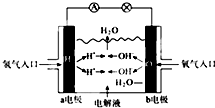

| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |
美国科学家约翰?马瑟和乔治?斯穆特由于为宇宙起源的大爆炸理论提供了支持,曾获得诺贝尔物理学奖.根据大爆炸理论,在大爆炸后约2h,诞生了大量的氢、少量的氦,以及极少量的锂.下列说法不正确的是( )
| A、氢原子获得一个电子也能变成稳定结构 |
| B、氢原子与氢离子都属于氢元素,它们的化学性质相同 |
| C、氦元素原子最外层有2个电子,故其化学性质稳定 |
| D、锂原子易失去最外层1个电子,形成最外层为2个电子的稳定结构 |
下列说法不正确的是( )
| A、金刚石和石墨互为同素异形体 | ||||
| B、1H、2H和3H互为同位素 | ||||
| C、18O和16O是两种不同的核素 | ||||
D、氡的放射性同位素
|