题目内容
 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:(1)①完成酸性高锰酸钾溶液和草酸(H2C2O4)溶液反应的离子方程式:
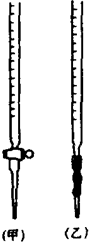
②高锰酸钾溶液应盛装于
③滴定中使用的指示剂是
④实验中测得的数据记录如下:
| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
A、滴定终点读数时俯视 B、滴定前有气泡,滴定后气泡消失
C、润洗锥形瓶 D、滴定过程中加入少量蒸馏水冲洗瓶壁
(2)取3支大小规格相同的试管,向试管中分别加入2mL 0.1mol.L-1酸性KMnO4 溶液,将其中一支试管放入冰水中,另一支试管放入80℃的热水中,第3支试管置于室温下(25℃).再向试管中同时加入2mL 0.1mol.L-1H2C2O4.请回答下列问题:
①第3支试管置于室温下(25℃),有什么作用?
②为了测定该化学反应速率,除已知试管、试管架、白纸外,本实验还缺少的仪器是:
③放在冰水中的试管在10秒时刚好反应完全,则用KMnO4表示的化学反应速率为v(KMnO4)=
(3)某同学设计了用惰性电极通电电解验证紫红色是MnO4-离子的方案,你认为可行吗?
考点:中和滴定
专题:实验题
分析:(1)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
③草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(H2C2O4)=
,据此分析判断;
(2)①改变条件后与原条件进行对比;
②本实验需要测量热水的温度和褪色的快慢;
③根据V=
计算;
(3)高锰酸根离子显紫色,在电流作用下向阳极移动.
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
③草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
(2)①改变条件后与原条件进行对比;
②本实验需要测量热水的温度和褪色的快慢;
③根据V=
| △c |
| △t |
(3)高锰酸根离子显紫色,在电流作用下向阳极移动.
解答:
解:I、(1)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2+2Mn2++8H2O;
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,甲为酸式滴定管,故答案为:甲;
③高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点,
故答案为:高锰酸钾溶液;加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(H2C2O4)=
,
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
滴定管用水洗净后直接注入KMnO4溶液,高锰酸钾溶液被稀释,使用的高锰酸钾溶液的体积偏大,测定的高锰酸钾的浓度偏低,故A符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(2)①实验的目的是看温度对反应速率的影响,故需与常温进行对照,故答案为:对照或对比;
②本实验需要控制温度,需要温度计,需要比较快慢,故需要秒表,故答案为:温度计、秒表;
③混合后c((KMnO4)=
=0.05mol/L,v((KMnO4)=
=0.005mol/(L?s),故答案为:0.005mol/(L?s);
(3)高锰酸离子带负电荷,在场作用下,向阳极移动,阳极附近紫红色加深,阴极附近紫红色变浅,氢离子在阴极得电子生成氢气,
故答案为:可以;阳极紫红色加深,阴极紫红色变浅且有无色气泡生成.
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2+2Mn2++8H2O;
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,甲为酸式滴定管,故答案为:甲;
③高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点,
故答案为:高锰酸钾溶液;加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
滴定管用水洗净后直接注入KMnO4溶液,高锰酸钾溶液被稀释,使用的高锰酸钾溶液的体积偏大,测定的高锰酸钾的浓度偏低,故A符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(2)①实验的目的是看温度对反应速率的影响,故需与常温进行对照,故答案为:对照或对比;
②本实验需要控制温度,需要温度计,需要比较快慢,故需要秒表,故答案为:温度计、秒表;
③混合后c((KMnO4)=
| 0.1mol/L×2mL |
| 2mL+2mL |
| 0.05mol/L |
| 10s |
(3)高锰酸离子带负电荷,在场作用下,向阳极移动,阳极附近紫红色加深,阴极附近紫红色变浅,氢离子在阴极得电子生成氢气,
故答案为:可以;阳极紫红色加深,阴极紫红色变浅且有无色气泡生成.
点评:本题考查氧化还原滴定原理与应用、探究影响速率的因素,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )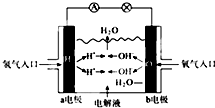

| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |