题目内容
5.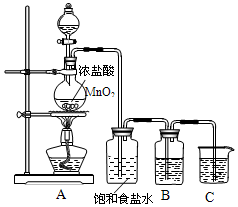 实验室制取氯气的装置如图:
实验室制取氯气的装置如图:(1)实验室制取氯气的化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;氧化剂MnO2
(2)实验室通常用饱和食盐水吸收杂质HCl,B瓶盛装的试剂是浓硫酸
(3)C装置吸收氯气用氢氧化钠溶液,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
(4)检验氯气是否泄漏用湿的淀粉KI试纸,若泄漏试纸变蓝色.
分析 (1)根据化学反应前后元素守恒确定产物;Cl元素化合价由-1价升高到0价,据氧化剂(降得还),还原剂(升失氧)来分析;
(2)饱和食盐水作用分析;浓硫酸作用分析;
(3)气是酸性气体,故用碱吸收;余的氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收;
(4)据氯气本身的性质分析;Cl2+2I-=I2+2Cl-,淀粉能使碘单质变蓝来分析.
解答 解:(1)根据元素守恒确定产物,故为Cl2↑;Mn元素化合价由+4价降低到+2价,故氧化剂为MnO2:故答案为:Cl2↑; MnO2;
(2)由反应的化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,故答案为:HCl;浓硫酸;
(3)氯气是酸性气体,故用碱吸收,因此用氢氧化钠溶液;杯中盛放的氢氧化钠溶液用来吸收多余的Cl2,反应的化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液 NaOH+Cl2=NaCl+NaClO+H2O;
(4)氯气本身具有强氧化性,因此用具有还原性淀粉KI来检验;由Cl2+2I-=I2+2Cl- 方程式知生成I2,能使淀粉变蓝,故答案为:淀粉KI; 蓝.
点评 本题考查实验室制备氯气,题目难度不大,注意氯气本身性质,尾气处理,并注意把握反应的原理以及实验的注意事项,

练习册系列答案
相关题目
16.工业上冶炼钛有如右反应:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$ Ti+2MgCl2该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
13.根据南方某城市环卫局提供的资料,该市平均每天生产垃圾1500t,其中生活垃圾800~900t.下列关于垃圾的说法正确的是( )
| A. | 瓜皮果壳-可回收垃圾 | B. | 医疗垃圾-危险废物 | ||
| C. | 玻璃制品-不可回收垃圾 | D. | 塑料-不可回收垃圾 |
20.在温度T1和T2时,分别将1.00 mol CH4和2.40 mol NO2充入体积为1L的密闭容器发生如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | n(CH4)/mol | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | T2时NO2的平衡转化率为70.0% | |
| B. | 该反应的△H<0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入1.00molCH4和2.40molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),平衡向正反应方向移动 |
17.关于1s、2s、3s、4s原子轨道的说法,正确的是( )
| A. | 电子只能在电子云轮廓图中运动 | |
| B. | 能层不同,电子云轮廓图形状不相同 | |
| C. | 轨道数目相同,电子云轮廓图形状、大小完全相同 | |
| D. | 能层不同,能级相同,电子云轮廓图形状相同 |
15.萃取碘水中的碘,不能选用的有机溶剂是( )
| A. | 乙醇 | B. | 乙醚 | C. | 己烯 | D. | 苯 |
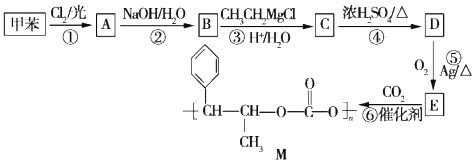
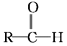 +R′-MgX→
+R′-MgX→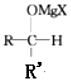 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$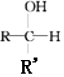 (R,R'均为烃基);
(R,R'均为烃基);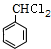 ,D
,D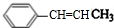 ,E
,E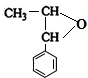 .
. .B与新制的Cu(OH)2悬浊液共热反应
.B与新制的Cu(OH)2悬浊液共热反应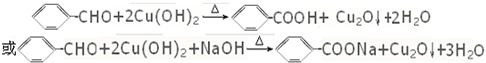 .
.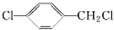 (填结构简式).
(填结构简式).