题目内容
15.根据下列微粒回答问题:11H、21H、31H、14C、14N、16O、35Cl2、37Cl2.①以上8种微粒共有8种核素,共种元素5.
②互为同位素的是11H、21H、31H.
③质量数相等的是14C和14N,中子数相等的是14C和16O.
分析 ①质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
②质子数相同,而中子数不同的原子,互称为同位素;
③原子符号左上角的数字为质量数;中子数=质量数-质子数.
解答 解:①11H、21H、31H、都属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有6种核素,5种元素,
故答案为:6;5;
②11H、21H、31H、都属于氢元素,质子数相同,而中子数不同互为同位素,
故答案为:11H、21H、31H;
③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,
故答案为:14C;14N; 14C、16O.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念、核外电子数的计算、试题培养了学生的分析能力及概念实质的理解能力,题目难度中等.

练习册系列答案
相关题目
12.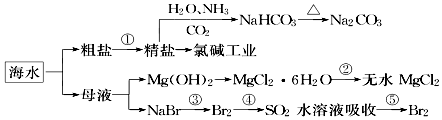 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
3.铁元素是高中化学中重要的金属元素,也是日常生活中不可缺少的重要元素.在高中学习中了解了铁及其化合物的性质与用途.某中学化学兴趣小组对Fe2+与Fe3+有关性质非常感兴趣,做了如下实验.
(1)探究Fe2+与Fe3+性质
请你用离子方程式和必要的文字解释实验3现象的原因MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,Fe2+具有还原性,MnO4-被还原生成了无色的Mn2+.请你描述实验4中空格的实验现象是先生成白色沉淀,一会儿变成灰绿色,最后成红褐色沉淀.
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
①根据上表信息,你可以得到结论是(任写两条):当浓度为0.1mol•L-1,上述四种溶液可以鉴别Fe2+、Fe3+、当浓度为0.01mol•L-1,只能用KSCN溶液、10%NaOH溶液来鉴别Fe2+、Fe3+;离子浓度不同,鉴别试剂的选择也不同.
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
(1)探究Fe2+与Fe3+性质
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
10.化学与社会、生产、生活紧密相关.下列说法正确的是( )
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
20.己知:60℃时,KNO3的溶解度为110g.在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到( )
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
7.下列反应中不属于可逆反应的是( )
| A. | 氮气和氢气的化合 | B. | 氯气溶于水 | ||
| C. | 氨气溶于水 | D. | 水的电解 |
4.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 27 mL 4℃的水中所含分子数约为1.5 NA个 | |
| B. | 电解精炼铜时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 | |
| C. | 标准状况下,22.4L乙烯中共价键数目为8 NA | |
| D. | pH=1的硫酸溶液所含的H+数为NA个 |
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题: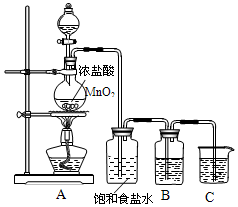 实验室制取氯气的装置如图:
实验室制取氯气的装置如图: