题目内容
6.下列实验操作中不正确的是( )| A. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容 | |
| C. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 | |
| D. | 称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
分析 A.蒸馏时温度计用于测量馏分的温度;
B.定容时,如果加水超过了刻度线,应重新配制;
C.配制稀硫酸时,应防止酸液飞溅;
D.氢氧化钠易潮解、变质,称量时尽量减少误差.
解答 解:A.蒸馏时温度计用于测量馏分的温度,应将温度计水银球置于蒸馏烧瓶支管口处,故A正确;
B.定容时,如果加水超过了刻度线,浓度变小,则应重新配制,故B错误;
C.浓硫酸溶于水放出大量的热,配制稀硫酸时,为防止酸液飞溅,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸,故C正确;
D.氢氧化钠易潮解、变质,称量时尽量减少误差,应将NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘,故D正确.
故选B.
点评 本题考查较为综合,涉及混合物分离提纯、溶液的配制、药品的称量等,为高频考点,侧重分析、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.下列粒子或物质中,只有氧化性的是( )
| A. | Fe2+ | B. | Fe3+ | C. | Fe3O4 | D. | FeO |
13.有机物 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④⑥⑦ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤⑦ |
10.某同学通过向FeI2溶液中滴加某些试剂的方法证明还原性:I->Fe2+>Br-,下列试剂肯定不需要使用的是( )
| A. | 淀粉 | B. | 溴水 | C. | 氯水 | D. | KSCN |
1.下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
| A. | ①②③④ | B. | ①②④ | C. | ③⑤ | D. | ①②④⑤ |
11.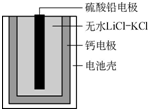 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
18.在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是( )
| A. | Al3+、Na+、SO42-、Cl- | B. | Na+、K+、CO32-、SO42- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Na+、Ba2+、Cl-、NO3- |
15.在下列饱和溶液中分别持续通入CO2,始终不会有沉淀或晶体析出的是( )
| A. | Na2SiO3 | B. | Ca(OH)2 | C. | Ca(NO3)2 | D. | Na2CO3 |
16.下列说法中正确的是( )
| A. | 电子云示意图中的小黑点表示原子核最外层的电子 | |
| B. | 某元素有多种同位素,天然存在的该元素其中一种同位素的丰度为75%,则100 g天然存在的该元素中,此同位素的质量为75 g | |
| C. | 核外电子的运动状态是由该电子的电子层、电子亚层、电子云的伸展方向和电子自旋方向共同决定的 | |
| D. | 电子离核越远能量越高,所以N层电子的能量一定高于M层电子的能量 |