题目内容
13.下列描述中正确的是( )| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | BF3是三角锥形分子 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
分析 A.CS2与CO2分子构型相同,根据二氧化碳的分子结构分析;
B.先求出中心原子的价层电子对数,再判断分子构型;
C.根据BF3中B含有的成键电子对判断;
D.先求出中心原子的价层电子对数,再判断杂化类型.
解答 解:A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故A错误;
C.ClO3-中Cl的价层电子对数=3+$\frac{1}{2}$(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B正确;
C.BF3中B的价层电子对数=3+$\frac{1}{2}$(3+1×3)=3,则空间构型为平面三角形,故C错误;
D.SiF4中Si的价层电子对数=4+$\frac{1}{2}$(4-1×4)=4,SO32-中S的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,所以中心原子均为sp3杂化,故D错误.
故选B.
点评 本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.A、B、C、D、E均为短周期主族元素.A、B、C位于同一周期相邻位置,他们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4.E原子半径是短周期元素原子半径最大的.则下列叙述正确的是( )
| A. | C和D能形成D2C2的离子化合物 | |
| B. | 由A、D原子构成的分子的结构是正四面体 | |
| C. | E和C只能形成E2C 一种化合物 | |
| D. | 由A、B、C、D四种元素形成的化合物可以是离子化合物 |
4.下列有关氢化物的叙述中正确的( )
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为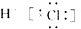 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
1.现有某氯化物与氯化镁的混合物,取95mg粉末完全溶于水后,与足量的硝酸银溶液反应后得到300mg氯化银沉淀,则该混合物中的另一氯化物是( )
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
5.下列化学用语的表达正确的是( )
| A. | 二氧化碳的比例模型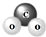 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: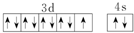 |
2.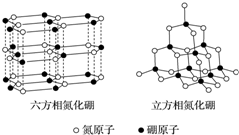 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 六方相氮化硼与石墨一样可以导电 | |
| B. | 立方相氮化硼含有σ键和π键,所以硬度大 | |
| C. | 两种晶体均为分子晶体 | |
| D. | 六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形 |
3.下列离子在溶液中能大量共存的是( )
| A. | H+、Fe2+、ClO-、Na+ | B. | Na+、H+、SO42-、CO32- | ||
| C. | Fe3+、Cl-、Br-、SCN- | D. | Al3+、NO3-、H+、NH4+ |
 .
.