题目内容
13.下列关于有机化合物的叙述中不正确的是( )| A. | 甲烷中的任意三个原子都不共面 | |
| B. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| C. | 天然气、沼气、坑道气的主要成分均是甲烷 | |
| D. | 丙烷和甲烷一样能与氯气发生取代反应 |
分析 A.甲烷为正四面体结构,空间3个点可共面;
B.CH2Cl2是纯净物,可知2个Cl为相邻位置;
C.天然气、沼气、坑道气均含甲烷;
D.丙烷和甲烷均为饱和烃,光照下可发生取代反应.
解答 解:A.甲烷为正四面体结构,空间3个点可共面,则甲烷中的任意三个原子都共面,故A错误;
B.CH2Cl2是纯净物,可知2个Cl为相邻位置,可知甲烷是四面体结构而不是正方形结构,故B正确;
C.甲烷为天然气、沼气、坑道气的主要成分,不纯易发生爆炸,应注意安全,故C正确;
D.丙烷和甲烷均为饱和烃,光照下与氯气可发生取代反应生成卤代烃,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.

练习册系列答案
相关题目
2.H2是一种很有前途的能源,以水为原料大量制取H2,最理想的途径是( )
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
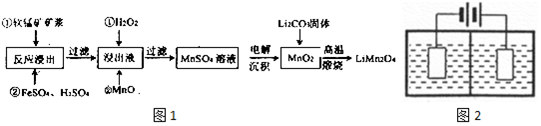
3.新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1:
有关物质的溶度积常数
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4.
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.

有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
2.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
| A. | 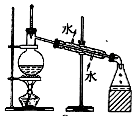 装置常用于分离互不相溶的液体混合物 | |
| B. | 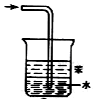 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 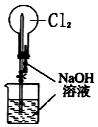 用装置不可以完成“喷泉”实验 | |
| D. | 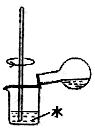 用装置稀释浓硫酸和铜反应冷却后的混合液 |
3.在反应3Cl2+2FeBr2═2FeCl3+2Br2中被还原的元素是( )
| A. | Fe | B. | Fe和Cl | C. | Cl | D. | Br |
 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题: