题目内容
3.新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1: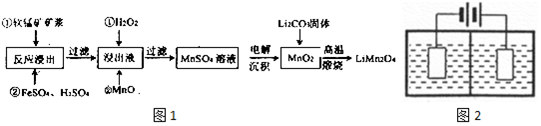
有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
分析 用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程:加入FeSO4、H2SO4,二氧化硅不溶,过滤得到含有Fe2+、Fe3+、Mn2+、Al3+的溶液,加入过氧化氢氧化亚铁离子,再加入MnO调节pH,将铁离子、铝离子沉淀,得到硫酸锰的溶液,电解沉积得到二氧化锰,再与碳酸锂固体高温下反应得到产品,据此分析解答.
解答 解:(1)锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,Li2Mn2O4中锰元素+3价,则LiMn2O4中锰元素有+4价,但只有一个锰原子得电子,另一个锰原子未得电子变价,也为+4价,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4;
故答案为:+3、+4;
(2)流程中,某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物),FeSO4有还原性,加入FeSO4的作用是与二氧化锰反应,使锰离子进入溶液;
加入MnO调节pH,将铁离子、铝离子沉淀,得到硫酸锰的溶液;
已知的Al(OH)3Ksp为4.5×10-33,当滤液中的pH为6时,则c(OH-)=10-8 mol•L-1滤液中所含铝离子的浓度为$\frac{4.5×1{0}^{-33}}{(1{0}^{-8})^{3}}$=4.5×10-9 mol•L-1;
故答案为:作还原剂,还原MnO2;调节滤液的pH,除去Fe3+和Al3+;4.5×10-9 mol•L-1;
(3)离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,阴极发生还原反应,阳极发生氧化反应,由流程可知,锰离子生成二氧化锰,反应式为Mn2+-2e-+2H2O=MnO2+4H+,则阳极室为硫酸锰溶液,阴极室为硫酸钠溶液;
故答案为:硫酸钠溶液;Mn2+-2e-+2H2O=MnO2+4H+;
(4)Fe2+与矿浆中MnO2反应的离子方程式为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
故答案为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
(5)高温煅烧生成锰酸锂,锰元素化合价降低,则氧元素升价到0价,化学方程式为:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑;
故答案为:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.

甲柜 | 乙柜 | 丙柜 | 丁柜 | 戊柜 |
盐酸、硫酸 | 烧碱、氢氧化钡 | 硫、红磷 | 铜、锌 | 碳酸钠、硝酸钾 |
现在新购进硝酸、苛性钾、碘和硝酸银溶液,下列对其保存方法不正确的是( )
A.硝酸装进棕色细口瓶放在甲柜 B.苛性钾固体用磨口玻璃塞广口瓶放在乙柜
C.碘单质用广口瓶装放在丙柜 D.硝酸银溶液用棕色磨口细口瓶放在戊柜
| A. | 12gNaHSO4晶体中所含阴离子数目为0.2NA | |
| B. | 23g金属钠与足量O2反应时,转移电子数目一定为NA | |
| C. | 1L 0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| D. | 标准状况下,11.2L CCl4中含有C-Cl键的数目为2NA |
| A. | 硅胶可用作食品的抗氧化剂 | |
| B. | 可用热碱水清洗炊具上的油渍 | |
| C. | 铁表面镀锌可增强其抗腐蚀性 | |
| D. | 大量燃烧化石燃料是导致雾霾天气的重要因素之一 |
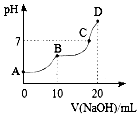 25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )
25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )| A. | C点溶液中含有NaHA和Na2A | |
| B. | NaHA溶液中水的电离程度比Na2A溶液中小 | |
| C. | B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)] | |
| D. | D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+) |
| A. | 甲烷中的任意三个原子都不共面 | |
| B. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| C. | 天然气、沼气、坑道气的主要成分均是甲烷 | |
| D. | 丙烷和甲烷一样能与氯气发生取代反应 |
| A. | Cl- | B. | Na+ | C. | NO3- | D. | HCO-3 |
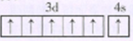 ;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.
;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.