题目内容
1.根据表的键能(kJ/mol)数据不能得出的结论是( )| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
分析 A.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
B.H(g)与F(g)结合放出热量;
C.键能越大越稳定;
D.H2Se和H2S结构相似,分子间只存在范德华力.
解答 解:A.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)-436kJ,故A正确;
B.H(g)与F(g)结合放出热量,H(g)+F(g)→HF (g)+565kJ,故B正确;
C.HF的键能大于H2S,键能越大越稳定,故C正确;
D.H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2Se>H2S,故D错误.
故选D.
点评 本题考查化学键与能量的关系等知识,侧重于学生的分析能力的考查,为高频考点,掌握键能与能量变化的关系是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.关于0.5mol/L CH3COOH与0.5mol/L 盐酸的比较,正确的是( )
| A. | 氢离子浓度相同 | |
| B. | 导电能力相同 | |
| C. | 相同体积时,中和NaOH的能力相同 | |
| D. | 加水稀释10倍后,溶液的pH值均上升1个单位 |
16.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2 BaSO4↓+Al(OH)3↓ |
6.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.(请写出计算过程)
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.(请写出计算过程)
13.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2=2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
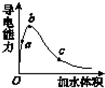 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题. 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则: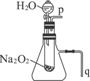 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.