题目内容
11.下列关于电解质溶液中离子关系的说法正确的是( )| A. | 0.1mol/L NaHCO3溶液中离子浓度关系:C(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) | |
| D. | 常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
分析 A.根据碳酸氢钠溶液中的物料守恒判断;
B.一水合氨的电离程度大于铵根离子的水解程度,混合液学生碱性,则c(OH-)>c(H+),结合电荷守恒判断各离子浓度大小;
C.硝酸根离子和钠离子都不水解,则c(Na+)=c(NO3-);
D.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子,次氯酸根离子与氢离子生成次氯酸,次氯酸能够氧化亚铁离子.
解答 解:A.0.1mol/L NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故A正确;
B.浓度相等时,一水合氨的电离程度大于铵根离子的水解程度,混合液呈碱性,则:c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.硝酸钠溶液中加入盐酸后,钠离子和硝酸根离子都不水解,则c(Na+)=c(NO3-),故C错误;
D.常温下pH=1的溶液为酸性溶液,溶液中存在大量氢离子,Fe2+、NO3-在酸性条件下发生氧化还原反应,ClO-与氢离子反应生成次氯酸,次氯酸能够氧化Fe2+,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查了离子方程式的书写,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握盐的水解原理及其影响,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
6.既可用来除去甲烷中的乙烯,又可用来鉴别甲烷与乙烯的方法是( )
| A. | 把气体通入足量液溴中 | B. | 在导管口处点燃 | ||
| C. | 一定条件下与H2发生加成反应 | D. | 把气体通入足量溴水中 |
3.在密闭容器中,进行反应X(g)+3Y(g)?2Z(g),达到平衡后,其他条件不变,只增加X的量,下列叙述中正确的是( )
| A. | 正反应速率增大,逆反应速率减小 | B. | X的转化率变大 | ||
| C. | Y的转化率变大 | D. | 新平衡时X的体积分数减小 |
20.下面列出了电解不同物质的电极反应式,其中错误的是( )
| A. | 电解饱和食盐水 阴极:Na++e-═Na | |
| B. | 电镀铜时(电解质溶液为CuSO4溶液) 阳极:Cu-2e-═Cu2+ | |
| C. | 电解熔融NaCl 阴极:Na++e-═Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |





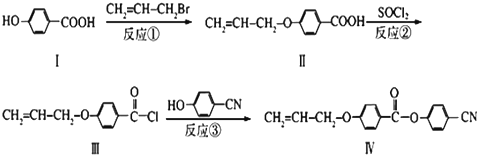
 (注明反应条件),因此,在碱性条件下,由Ⅳ与
(注明反应条件),因此,在碱性条件下,由Ⅳ与 反应生成Ⅱ,其反应类型为取代反应.
反应生成Ⅱ,其反应类型为取代反应. 铝和氢氧化钾都是重要的工业产品,请回答问题:
铝和氢氧化钾都是重要的工业产品,请回答问题: