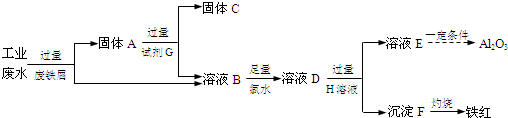
题目内容
4.氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是( )| A. | “两水”都是混合物,溶液中含有的粒子种类、数目相同 | |
| B. | “两水”中存在相同弱电解质的电离 | |
| C. | “两水”都有刺激性气味,都能漂白有机色素 | |
| D. | “两水”放置时间较久后,都会因为相同的原理而变质 |
分析 氯水中存在的微粒有:Cl2、H2O和HClO、Cl-、ClO-、H+、OH-,氨水中存在的微粒有:NH3、H2O和NH3•H2O、NH4+、H+、OH-,结合对应粒子的性质解答该题.
解答 解:A.氯水中存在的微粒有:Cl2、H2O和HClO、Cl-、ClO-、H+、OH-,氨水中存在的微粒有:NH3、H2O和NH3•H2O、NH4+、H+、OH-,故A错误;
B.一水合氨、次氯酸都是弱电解质,都是部分电离,故B正确;
C.氨水无漂白性,故C错误;
D.氯水变质是因为HClO见光分解,氨水变质是由于氨气的挥发,故D错误;
故选:B.
点评 本题考查氯水和氨水的组成和性质,为高频考点,侧重于学生的分析能力和基础知识的综合考查,明确氯水、氨水成分是解题关键.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
15.下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体,生成Cu(NO3)2 | |
| C. | 与Na2CO3反应放出CO2气体,生成NaNO3 | |
| D. | 与S单质混合共热时生成H2SO4和NO2 |
12.将一定量的SO2(g)和O2(g)分别通入体积为2 L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据( )
| 实验 编号 | 温度 /℃ | 平衡常数 /mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=2.4 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v(SO2)=0.2 mol•L-1•min-1 |
19.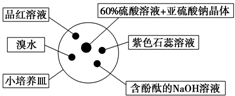 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
16.下列实验过程中,溶液的pH大于7的是( )
| A. | 向NaCl溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀HCl溶液中滴加稀HNO3 | D. | 向NaOH溶液中滴加Na2CO3溶液 |
13.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:W>Z | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
14.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |