题目内容
14.基态Fe原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色.分析 Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,硫氰化铁为血红色;
解答 解:Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5.6.4g Cu和足量的硫粉在充分反应,2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,下列有关叙述正确的是( )
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
2.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| B. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| C. | 标准状况下,18g水所含原子数为NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
3.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.则下列判断不正确的是( )
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 | |
| C. | 原子半径由大到小的顺序为:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
4.氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是( )
| A. | “两水”都是混合物,溶液中含有的粒子种类、数目相同 | |
| B. | “两水”中存在相同弱电解质的电离 | |
| C. | “两水”都有刺激性气味,都能漂白有机色素 | |
| D. | “两水”放置时间较久后,都会因为相同的原理而变质 |
 .
.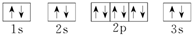 ;D
;D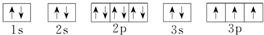 .
.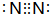 ,氢化物
,氢化物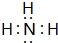 .
.