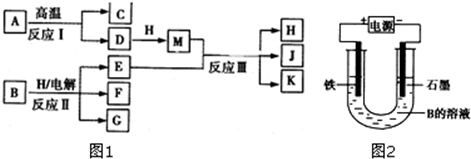
题目内容
氢氧化铝受热分解:化学方程式: .
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:氢氧化铝受热分解氧化铝和水,据此书写方程式.
解答:
解:氢氧化铝受热分解氧化铝和水,反应的化学方程式为:2Al(OH)3
Al2O3+3H2O.
故答案为:2Al(OH)3
Al2O3+3H2O.
| ||
故答案为:2Al(OH)3
| ||
点评:本题考查学生氢氧化铝的不稳定性,受热易分解为氧化铝和水,难度不大.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
有关如图所示化合物的说法不正确的是( )
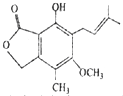

| A、该有机物的分子式为C15H18O4 |
| B、1mol该化合物最多可以与2molNaOH反应 |
| C、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
下列物质既能与盐酸反应,又能与NaOH 溶液反应的是( )
| A、KHCO3 |
| B、NaOH |
| C、KAl(SO4)2 |
| D、Cu(NO3)2 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、甲基橙显黄色的溶液:AlO2-、HCO3-、Na+、K+ |
| B、c(H+)=1×10-1mol?L-1的溶液:IO3-、I-、K+、NH4+ |
| C、各离子物质的量浓度相等的溶液:K+、Na+、SO42-、NO3- |
| D、无色透明的溶液:NH4+、Na+、Cl-、CH3COO- |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
将c(H+)=10-2mol?L-1的醋酸和盐酸分别稀释100倍,稀释后两种溶液的c(H+)分别为a和b,则a和b的关系为( )
| A、a>b | B、a<b |
| C、a=b | D、无法判断 |
下列实验操作或结论正确的是( )
| A、配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 |
| B、实验室里需要480 mL 2.0 mol?L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| C、25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 |
| D、实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是:用天平称27.8 g绿矾,放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
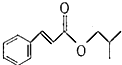 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下: