题目内容
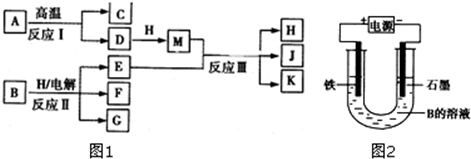
如图1所示反应I、反应Ⅱ和反应Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,E为单质,D和K均可用作干燥剂,H是由最轻的元素和地壳中含量最高的元素组成的化合物,J是一种具有漂白作用的盐,反应Ⅲ和E与G反应的原理相同.
(1)C与J的水溶液反应生成的含氧酸的结构式是
(2)E与G反应的用途是
(3)J久置后,即便不接触水、空气,本身也会逐渐分解生成K,并放出气体,该反应的化学方程式是
(4)工业上测定反应Ⅲ产品的有效成分J 的含量,先将一定量产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是
②生成I2的反应的离子方程式是
(5)若将0.1mol E通入100mlFeBr2溶液中,溶液中全部Fe2+恰好都变为Fe3+,原FeBr2溶液的物质的量浓度为 ,该过程反应的离子方程式是
(6)若反应Ⅱ采用如图2所示装置,出现的现象是 .

(1)C与J的水溶液反应生成的含氧酸的结构式是
(2)E与G反应的用途是
(3)J久置后,即便不接触水、空气,本身也会逐渐分解生成K,并放出气体,该反应的化学方程式是
(4)工业上测定反应Ⅲ产品的有效成分J 的含量,先将一定量产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是
②生成I2的反应的离子方程式是
(5)若将0.1mol E通入100mlFeBr2溶液中,溶液中全部Fe2+恰好都变为Fe3+,原FeBr2溶液的物质的量浓度为
(6)若反应Ⅱ采用如图2所示装置,出现的现象是
考点:无机物的推断
专题:
分析:H是由最轻的元素和地壳中含量最高的元素组成的化合物,则H为H2O,A、B为化合物,C是温室气体之一,则C为CO2,D和K均可用做干燥剂,结合反应条件判断为D为CaO,A为CaCO3,M为Ca(OH)2,J是一种具有漂白作用的盐,推断J为Ca(ClO)2,K为CaCl2,E为Cl2,反应Ⅲ和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,G为NaOH,F为H2,据此解答.
解答:
解:H是由最轻的元素和地壳中含量最高的元素组成的化合物,则H为H2O,A、B为化合物,C是温室气体之一,则C为CO2,D和K均可用做干燥剂,结合反应条件判断为D为CaO,A为CaCO3,M为Ca(OH)2,J是一种具有漂白作用的盐,推断J为Ca(ClO)2,K为CaCl2,E为Cl2,反应Ⅲ和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,G为NaOH,F为H2,
(1)CO2与Ca(ClO)2的水溶液反应生成的含氧酸为HClO,其结构式是H-O-Cl,故答案为:H-O-Cl;
(2)E与G反应是氯气和氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,可以制漂白液,氯气的尾气处理等,故答案为:制漂白液,氯气的尾气处理等;
(3)J[Ca(ClO)2]久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体,该气体为氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,
故答案为:Ca(ClO)2=CaCl2+O2↑;
(4)①碘单质遇淀粉溶液变蓝,用Na2S2O3标准溶液滴定I2时,选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,故答案为:淀粉溶液;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(5)若将0.1mol Cl2通入100mlFeBr2溶液中,溶液中Fe2+的还原性大于Br-的还原性;通入氯气会先氧化Fe2+离子,反应完全后再氧化Br-,溶液中全部Fe2+恰好都变为Fe3+,则Br-为参与反应,设FeBr2的物质的量为x mol,根据电子转移守恒,则x mol×1=0.1mol×2,故x=0.2,则原FeBr2溶液的物质的量浓度为
=2mol/L,该过程反应的离子方程式是:2Fe2++Cl2=2Fe3++2 Cl-,
故答案为:2mol/L;2Fe2++Cl2=2Fe3++2 Cl-;
(6)Fe为阳极,失去电子生成Fe2+,石墨为阴极,水在阴极放电生成氢气与氢氧根离子,电解一段时间后在U形管的底部生成氢氧化亚铁,故出现的现象为:石墨上有无色气体产生,电解一段时间后在U形管的底部出现白色沉淀,
故答案为:石墨上有无色气体产生,电解一段时间后在U形管的底部出现白色沉淀.
(1)CO2与Ca(ClO)2的水溶液反应生成的含氧酸为HClO,其结构式是H-O-Cl,故答案为:H-O-Cl;
(2)E与G反应是氯气和氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,可以制漂白液,氯气的尾气处理等,故答案为:制漂白液,氯气的尾气处理等;
(3)J[Ca(ClO)2]久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体,该气体为氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,
故答案为:Ca(ClO)2=CaCl2+O2↑;
(4)①碘单质遇淀粉溶液变蓝,用Na2S2O3标准溶液滴定I2时,选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,故答案为:淀粉溶液;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(5)若将0.1mol Cl2通入100mlFeBr2溶液中,溶液中Fe2+的还原性大于Br-的还原性;通入氯气会先氧化Fe2+离子,反应完全后再氧化Br-,溶液中全部Fe2+恰好都变为Fe3+,则Br-为参与反应,设FeBr2的物质的量为x mol,根据电子转移守恒,则x mol×1=0.1mol×2,故x=0.2,则原FeBr2溶液的物质的量浓度为
| 0.2mol |
| 0.1L |
故答案为:2mol/L;2Fe2++Cl2=2Fe3++2 Cl-;
(6)Fe为阳极,失去电子生成Fe2+,石墨为阴极,水在阴极放电生成氢气与氢氧根离子,电解一段时间后在U形管的底部生成氢氧化亚铁,故出现的现象为:石墨上有无色气体产生,电解一段时间后在U形管的底部出现白色沉淀,
故答案为:石墨上有无色气体产生,电解一段时间后在U形管的底部出现白色沉淀.
点评:本题考查无机物推断,注意掌握中学常见的工业生产原理,根据物质性质的应用、反应特征条件和产物性质进行推断,题目难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列说法正确的是( )
| A、明矾[KAl(SO4)2?12H2O]溶解在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、玻璃具有耐腐蚀性,可以用玻璃试剂瓶长期保存酸、碱溶液 |
| C、浓H2SO4有强氧化性,但常温下可以用铁槽车运输 |
| D、将SO2通入溴水,溴水褪色后加热能恢复原色 |
下列关于常见有机化合物的说法中,正确的是( )
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
向明矾溶液里滴加Ba(OH)2溶液,当SO42-离子恰好沉淀完全时,铝元素的存在形式是( )
| A、一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中 |
| B、一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中 |
| C、全部为Al(OH)3沉淀 |
| D、几乎全部以[Al(OH)4]-形式存在于溶液中 |
下列各组离子能大量共存的是( )
| A、加入KSCN显红色的溶液:K+、NH+4、Cl-、S2- |
| B、“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
| C、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
| D、无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
 在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变 化如下表则下列判断正确的是( )
在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变 化如下表则下列判断正确的是( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A、平衡时NO的转化率是3.5% |
| B、右图中表示NO2变化的曲线是a |
| C、容器内气体的密度保持不变能说明该反应已达到平衡状态 |
| D、当v逆 (NO)=2v正(O2) 时能说明该反应已达到平衡状态 |