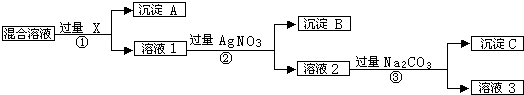
题目内容
将c(H+)=10-2mol?L-1的醋酸和盐酸分别稀释100倍,稀释后两种溶液的c(H+)分别为a和b,则a和b的关系为( )
| A、a>b | B、a<b |
| C、a=b | D、无法判断 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:c(H+)=10-2mol?L-1的醋酸和盐酸,醋酸浓度大于盐酸,分别稀释100倍时,HCl完全电离,但促进醋酸电离,导致稀释后溶液中c(H+)都减小,据此分析解答.
解答:
解:c(H+)=10-2mol?L-1的醋酸和盐酸,醋酸浓度大于盐酸,分别稀释100倍时,HCl完全电离,但促进醋酸电离,导致稀释后溶液中c(H+)都减小,但醋酸浓度减小程度小于盐酸,所以稀释后c(H+)醋酸大于盐酸,则a>b,故选A.
点评:本题考查弱电解质的电离,明确弱电解质电离影响因素是解本题关键,注意:加水稀释虽然促进醋酸电离,但溶液中氢离子浓度仍然减小,为易错点.

练习册系列答案
相关题目
下列各组离子能大量共存的是( )
| A、加入KSCN显红色的溶液:K+、NH+4、Cl-、S2- |
| B、“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
| C、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
| D、无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
从海水中提取溴常用的一种工艺涉及以下过程:则正确的步骤为( )
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
下列有关叙述不正确的是( )
| A、冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小 |
| B、若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸 |
| C、可逆反应的正、逆反应平衡常数数值互为倒数 |
| D、电镀铜时,纯铜或石墨做阳极,电镀液为CuSO4溶液 |
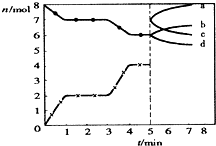 高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )
高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )A、2min时,
| ||||
| B、0~lmin,v(CO)=1 mol/(L?min);1~3min时,v(CO)=v(CO2) | ||||
| C、3min时温度由T1升高到T2,则x>O | ||||
| D、5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
 在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变 化如下表则下列判断正确的是( )
在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变 化如下表则下列判断正确的是( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A、平衡时NO的转化率是3.5% |
| B、右图中表示NO2变化的曲线是a |
| C、容器内气体的密度保持不变能说明该反应已达到平衡状态 |
| D、当v逆 (NO)=2v正(O2) 时能说明该反应已达到平衡状态 |