题目内容
18. A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).
A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).(1)若A在通常情况下是固体,则A,B,C,D,E化学式分别为:AS;BH2S;CSO2;DSO3;EH2SO4.
(2)若A在通常情况下是气体,则A,B,C,D,E化学式分别为:AN2;BNH3;CNO;DNO2;EHNO3.
分析 (1)根据A在通常情况下是固体,根据A能与氢气反应且能连续被氧化生成D,D与水生成E,可推知A为S,硫与氢气反应生成B为H2S,硫与氧化反应生成C为SO2,二氧化硫与氧化反应生成D为SO3,三氧化硫与水反应生成E为H2SO4,浓硫酸与铜能反应生成二氧化硫,符合各物质转化关系,据此答题;
(2)若A在通常情况下是气体,根据A能与氢气反应且能连续被氧化生成D,D与水生成E,可推知A为N2,N2与氢气反应生成B为NH3,氮气或氨气都能与氧化反应生成C为NO,NO与氧化反应生成D为NO2,NO2与水反应生成E为HNO3,稀HNO3与铜能反应生成NO,符合各物质转化关系,据此答题;
解答 解:(1)根据A在通常情况下是固体,根据A能与氢气反应且能连续被氧化生成D,D与水生成E,可推知A为S,硫与氢气反应生成B为H2S,硫与氧化反应生成C为SO2,二氧化硫与氧化反应生成D为SO3,三氧化硫与水反应生成E为H2SO4,浓硫酸与铜能反应生成二氧化硫,符合各物质转化关系,
故答案为:S;H2S;SO2;SO3;H2SO4;
(2)若A在通常情况下是气体,根据A能与氢气反应且能连续被氧化生成D,D与水生成E,可推知A为N2,N2与氢气反应生成B为NH3,氮气或氨气都能与氧化反应生成C为NO,NO与氧化反应生成D为NO2,NO2与水反应生成E为HNO3,稀HNO3与铜能反应生成NO,符合各物质转化关系,
故答案为:N2;NH3;NO;NO2;HNO3.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
10.CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
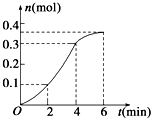

| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
3. 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | M点对应的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | N点对应的溶液中:K+、NH${\;}_{3}^{+}$、HCO${\;}_{3}^{-}$、Cl- | |
| C. | S点对应的溶液中:Na+、Ag+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | R点对应的溶液中:Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$、Cl- |
10.下列叙述错误的是( )
| A. | 已知在常温下醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol•L-1 | |
| B. | 把物质的量浓度相等的盐酸和醋酸溶液分别稀释m倍和n倍,欲使稀释后两溶液的pH相同,则m>n | |
| C. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol•L-1,则该溶液的pH可能是2或12 | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,酸碱恰好完全反应时所得溶液的pH=7,因为5<7<8,在石蕊的变色范围内,所以选择石蕊作为指示剂 |
7.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与锌粉反应:Cu2++Zn═Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe2++6H+═Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与CuSO4 溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
8.现有氧化铁和氧化铜的混合物mg,加入2.5mol/L的硫酸溶液40mL时,恰好完全溶解.若将2mg这种混合物在氢气流中加热并充分反应,冷却后剩余固体的质量为( )
| A. | 0.8g | B. | 1.6mg | C. | (2m-3.2g) | D. | (2m-1.6)g |
