题目内容
6.下列有关分子和原子的说法中,错误的是( )| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
分析 A.原子核和核外电子构成原子;
B.化学性质就是由分子来保持的;
C.分子的质量不一定比原子的质量大;
D.原子是化学变化中最小微粒.
解答 解:A.原子是由原子核和核外电子构成的,故A正确;
B.水是由水分子构成的,其化学性质就是由水分子来保持的,故B正确;
C.分子的质量不一定比原子的质量大,只能说由原子构成的分子,其质量比构成它的原子的质量大,故C错误;
D.化学反应中,分子可分成原子,原子重新组合成分子,原子是化学变化中最小微粒,故D正确.
故选C.
点评 本题主要考查了分子、原子的本质区别和联系及有关原子的结构的指示,题目难度不大,培养学生的微粒观.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列说法正确的是( )
| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
17.下列离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 用氯化铁溶液腐蚀铜板:Fe3++Cu═Cu2++Fe2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
14.短周期主族元素X、Y、Z、W原子序数依次增大,X元素的单质可在自然界中形成最硬的矿石,Y原子最外层有6个电子,Z元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,W与X同主族.下列叙述正确的是( )
| A. | 原子最外层电子数由少到多的顺序:X=W<Y<Z | |
| B. | 原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 元素非金属性由强到弱的顺序:X、Y、W | |
| D. | 元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
1.双氢青蒿素治疟疾疗效是青蒿素的10倍.一定条件下,由青蒿素合成双氢青蒿素示意如下: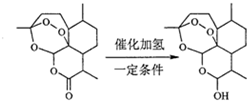
下列关于叙述不正确的是( )

下列关于叙述不正确的是( )
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
18.下列工业生产中,用石灰石作为原料的是( )
①海水提镁②氯碱工业③制普通玻璃④工业制硫酸⑤制漂白粉⑥冶炼生铁⑦制硅酸盐水泥⑧工业制高纯硅.
①海水提镁②氯碱工业③制普通玻璃④工业制硫酸⑤制漂白粉⑥冶炼生铁⑦制硅酸盐水泥⑧工业制高纯硅.
| A. | ①③⑤⑥⑦ | B. | ①②⑤⑦⑧ | C. | ②③④⑤⑥ | D. | ①③⑥⑦⑧ |
16.下列有关SO2的说法不正确的是( )
| A. | 把SO2通入紫色石蕊溶液中,石蕊溶液 会变红 | |
| B. | 把SO2通入品红溶液中,品红溶液会褪色 | |
| C. | 将足量SO2通入酸性高锰酸钾溶液中,溶液褪色 | |
| D. | 把SO2通入氯化钡溶液中,溶液会出现白色沉淀 |
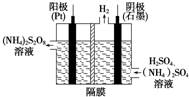 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.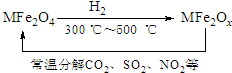 新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:
新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图: