题目内容
(1)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+.这说明维生素C具有 (填氧化性或还原性)
(2)2Na+O2═Na2O2反应中,
① 被氧化, 是氧化剂,氧化产物是 ,过氧化钠中氧元素的化合价是
②此反应中若转移了2mol的电子,则需要氧气 mol
③用单线桥或双线桥法表示反应电子转移的方向和数目
(3)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2.
(2)2Na+O2═Na2O2反应中,
①
②此反应中若转移了2mol的电子,则需要氧气
③用单线桥或双线桥法表示反应电子转移的方向和数目
(3)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2.
考点:氧化还原反应,氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:(1)Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(2)2Na+O2═Na2O2反应中,Na元素的化合价升高,O元素的化合价降低,该反应转移2e-,以此来解答;
(3)根据反应中氧化剂的氧化性大于氧化产物的氧化性来判断.
(2)2Na+O2═Na2O2反应中,Na元素的化合价升高,O元素的化合价降低,该反应转移2e-,以此来解答;
(3)根据反应中氧化剂的氧化性大于氧化产物的氧化性来判断.
解答:
解:(1)Fe元素的化合价降低,则维生素C中某元素的化合价升高,说明维生素C具有还原性,故答案为:还原性;
(2)①2Na+O2═Na2O2反应中,Na元素的化合价升高,被氧化,Na2O2为氧化产物,O元素的化合价降低,则O2为氧化剂,过氧化钠中氧元素的化合价是-1价,
故答案为:Na;O2;Na2O2;-1;
②由反应可知,该反应转移2e-,若转移了2mol的电子,则需要氧气1mol,故答案为:1;
③2Na+O2═Na2O2反应中,Na元素的化合价升高,失去的电子数为2,O元素得到的电子数为2,则双线桥法表示反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(3)①2FeCl3+2KI═2KCl+2FeCl2+I2,氧化性顺序是Fe3+>I2,②2FeCl2+Cl2═2FeCl3,氧化性顺序是Cl2>Fe3+,所以氧化性顺序是Cl2>Fe3+>I2;
故答案为:D.
(2)①2Na+O2═Na2O2反应中,Na元素的化合价升高,被氧化,Na2O2为氧化产物,O元素的化合价降低,则O2为氧化剂,过氧化钠中氧元素的化合价是-1价,
故答案为:Na;O2;Na2O2;-1;
②由反应可知,该反应转移2e-,若转移了2mol的电子,则需要氧气1mol,故答案为:1;
③2Na+O2═Na2O2反应中,Na元素的化合价升高,失去的电子数为2,O元素得到的电子数为2,则双线桥法表示反应电子转移的方向和数目为
 ,故答案为:
,故答案为: ;
;(3)①2FeCl3+2KI═2KCl+2FeCl2+I2,氧化性顺序是Fe3+>I2,②2FeCl2+Cl2═2FeCl3,氧化性顺序是Cl2>Fe3+,所以氧化性顺序是Cl2>Fe3+>I2;
故答案为:D.
点评:本题考查氧化还原反应,明确各元素的化合价变化是解答该题的关键,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
X、Y、Z、R和W代表原子序数依次增大的5种短周期元素,X与Z、Y与W同主族,Y是地壳中含量最多的元素,W元素与X元素可以形成18电子的分子,R元素的简单例子是同周期元素中半径最小的,下列说法正确的是( )
| A、含R元素的盐溶液可能显酸性,也可能显碱性 |
| B、Y分别与X和Z形成化合物,这些化合物的晶体类型相同 |
| C、Y元素氢化物的沸点比W元素氢化物的沸点低 |
| D、原子半径从小到大:X<Y<R<W |
下列离子方程式正确的是( )
| A、二氧化硅与氢氧化钠溶液反应:SiO2+2Na++2OH-=NaSiO3+H2O |
| B、向Ba(OH)2溶液中逐滴滴入NaHSO4溶液至溶液刚好呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| D、向碳酸氢钠溶液中滴入少量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
下列物质性质的变化规律,与共价键键能大小有关的是( )
| A、F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B、HF、HCl、HBr、HI的热稳定性依次减弱 |
| C、H2O熔沸点高于H2S.HF熔沸点高于HCl |
| D、NaF、NaCl、NaBr、Nal的熔点依次降低 |
能正确表示下列反应的离子方程式是( )
| A、CuCl2溶液中加入少量氨水:Cu2++2OH-═Cu(OH)2↓ |
| B、向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
| C、小苏打溶液中加足量澄清石灰水:HCO3?+Ca2++OH-═CaCO3↓+H2O |
| D、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
下列有关离子(或物质)的检验及结论,正确的是( )
A、..向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO
| ||
| B、.检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | ||
| C、.焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | ||
| D、用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
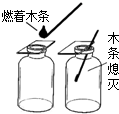 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
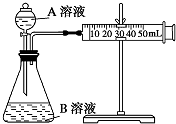 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.