题目内容
15.某无色混合气体可能含有Cl2、O2、NH3、NO、NO2中的两种或多种,现将此混合气体经过浓硫酸后体积减小,将剩余气体排人装有空气的试管中,气体很快变成红棕色,对于原混合气体成分的判断错误的是( )| A. | 可能有O2 | B. | 肯定没有Cl2、NO2 | C. | 肯定有NH3 | D. | 肯定有NO |
分析 气体无色透明可知原混合气体中一定不含Cl2、NO2,经过浓硫酸后体积减小,说明原混合气体含有NH3,将剩余气体排人装有空气的试管中,气体很快变成红棕色,说明原混合气体中含有NO,则一定不含O2,据此分析.
解答 解:气体无色透明可知原混合气体中一定不含Cl2、NO2,经过浓硫酸后体积减小,说明原混合气体含有NH3,将剩余气体排人装有空气的试管中,气体很快变成红棕色,说明原混合气体中含有NO,则一定不含O2,因此混合气体中一定含有NH3、NO,一定不含Cl2、NO2、O2,
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及发生的反应为解答的关键,注意气体的颜色及信息推断物质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )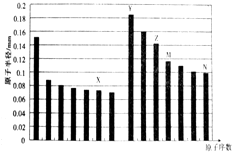

| A. | Y、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | M的氧化物既能碱反应又能和氢氟酸反应,但是该氧化物是典型的酸性氧化物 | |
| D. | 工业上常用的电解Y和N形成的化合物的水溶液制取Y的单质 |
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 向反应后的深蓝色溶液中加入乙醇,不会产生任何现象 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
10.如图是某太阳光伏电池示意图.则有关叙述正确的是( )


| A. | 光伏电池是将化学能转变为电能 | |
| B. | 光伏电池是将太阳能转变为热能 | |
| C. | 电流从b流向a | |
| D. | 图中P型半导体为负极,N型半导体为正极 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
7.向下列配合物的水溶液中加入AgNO3,不能生成AgCl沉淀的是( )
| A. | [Co(NH3)4Cl3]Cl | B. | [Co(NH3)3Cl3] | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)5Cl]Cl3 |
4.传感器可以检测空气中SO2的含量,传感器工作原理如图所示.下列叙述正确的是( )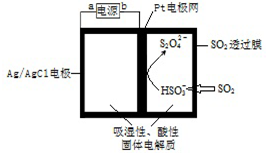

| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
5.实验室常用下列反应制备S02:Na2S03+H2S04═Na2S04+H20+S02↑,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
 A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.
A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.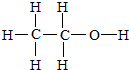 ;写出其官能团的电子式
;写出其官能团的电子式 ,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为
,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为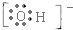 ,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.
,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.