题目内容
13.下列用品的主要成分及其用途对应不正确的是( )| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Fe | NaHCO3 | Si | Fe2O3 |
| 用途 | 可运输浓硫酸 | 发酵 | 光导纤维 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下浓硫酸和Fe发生钝化现象;
B.NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质;
C.光导纤维的主要成分是二氧化硅;
D.Fe2O3是红棕色固体,能作涂料等.
解答 解:A.常温下浓硫酸和Fe发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以常温下可以用铁制容器运输浓硫酸,故A正确;
B.NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,故B正确;
C.光导纤维的主要成分是二氧化硅,Si能作太阳能电池、硅芯片、半导体材料等,故C错误;
D.Fe2O3是红棕色固体,能作涂料、油漆等,故D正确;
故选C.
点评 本题考查物质用途,明确物质性质是解本题关键,性质决定用途,用途体现性质,知道常见物质性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.该反应为吸热反应(选填“吸热”、“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(7)若在(6)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b.
a.等于1.0mol b.大于1.0molc.大于0.5mold.无法确定.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(7)若在(6)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b.
a.等于1.0mol b.大于1.0molc.大于0.5mold.无法确定.
4.下列说法中错误的是( )
| A. | 烯烃各同系物中碳的质量分数相等 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 分子量相同的两种物质不一定是同分异构体 | |
| D. | C2H6和C4H10一定是同系物 |
8.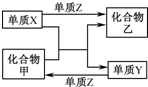 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )
 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | Fe | H2 | O2 | H2O | Fe3O4 |
| B | Mg | C | O2 | CO2 | MgO |
| C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| D | Cl2 | N2 | H2 | NH3 | HCl |
| A. | A | B. | B | C. | C | D. | D |
18.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1.
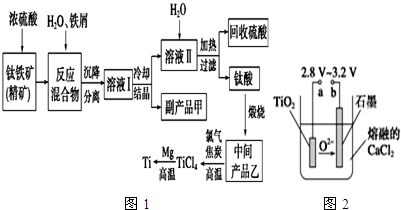
请回答下列问题.
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于10时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+).
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2C+2Cl2=TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1 000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2+4e-═Ti+2O2-.

请回答下列问题.
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+).
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2C+2Cl2=TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1 000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2+4e-═Ti+2O2-.
5.在pH=0的无色溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、AlO2- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+.、Mg2+、SO42-、Cl- |
3.某溶液中含有MgCl2的浓度为2mol.L-1,含AlCl3的浓度为3mol.L-1,体积为200mL,将此溶液中的Mg2+转化为沉淀分离出来,至少需要4mol.L-1的NaOH溶液的体积是( )
| A. | 0.2L | B. | 0.5L | C. | 0.65L | D. | 0.8L |