题目内容
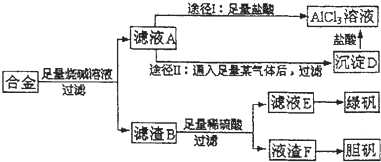
某混合物A,含有KAl(SO4)2、Al2O3,在一定条件下可实现如图所示的物质之间的变化:

据此判断:
(1)固体C所含物质的化学式为 ;
(2)反应①的离子方程式为 ;
(3)欲用实验证明固体E中有NH4+存在,按下列要求填空:
①实验操作: ;
②实验现象: ;
③有关反应的离子方程式: .

据此判断:
(1)固体C所含物质的化学式为
(2)反应①的离子方程式为
(3)欲用实验证明固体E中有NH4+存在,按下列要求填空:
①实验操作:
②实验现象:
③有关反应的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用,常见离子的检验方法,镁、铝的重要化合物
专题:元素及其化合物
分析:由流程图可知,KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3;向沉淀中加NaOH溶液,Al2O3可与NaOH溶液反应生成NaAlO2;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,Al(OH)3受热分解生成Al2O3;溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4.
(1)Al(OH)3受热分解生成Al2O3;
(2)反应①为Al2O3可与NaOH溶液反应;
(3)NH4+的检验方法为:取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝色.
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,Al(OH)3受热分解生成Al2O3;溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4.
(1)Al(OH)3受热分解生成Al2O3;
(2)反应①为Al2O3可与NaOH溶液反应;
(3)NH4+的检验方法为:取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝色.
解答:
解:由流程图可知,KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3;向沉淀中加NaOH溶液,Al2O3可与NaOH溶液反应生成NaAlO2;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,Al(OH)3受热分解生成Al2O3;溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4.
(1)分析推断可知,流程中的固体C为Al(OH)3受热分解生成Al2O3,故答案为:Al2O3;
(2)反应①Al2O3可与NaOH溶液反应的离子方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(3)欲用实验证明固体E中有NH4+存在:
①实验操作:取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口;
②实验现象:试纸变蓝色;
③有关反应的离子方程式:OH-+NH4+
NH3↑+H2O,
故答案为:①取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口;
②试纸变蓝色;
③OH-+NH4+
NH3↑+H2O.
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,Al(OH)3受热分解生成Al2O3;溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4.
(1)分析推断可知,流程中的固体C为Al(OH)3受热分解生成Al2O3,故答案为:Al2O3;
(2)反应①Al2O3可与NaOH溶液反应的离子方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(3)欲用实验证明固体E中有NH4+存在:
①实验操作:取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口;
②实验现象:试纸变蓝色;
③有关反应的离子方程式:OH-+NH4+
| ||
故答案为:①取少量固体于E试管中,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸靠近试管口;
②试纸变蓝色;
③OH-+NH4+
| ||
点评:解题的关键是抓住铝盐及氧化铝的性质和铵根离子检验方法等.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
下列各变化:①橡胶的硫化 ②石油的裂化 ③植物油的氢化 ④油脂的皂化 ⑤动物油的熔化 ⑥蔗糖的炭化 ⑦塑料的老化.其中属于化学变化的是( )
| A、全部 | B、②③④⑥⑦ |
| C、①②③④⑤⑥ | D、①②③④⑥⑦ |
下列判断不正确的是( )
| A、碱性氧化物一定是金属氧化物 |
| B、正四面体分子中键角一定是109°28′ |
| C、在D216O中,质量数之和是质子数之和的两倍 |
| D、非金属氧化物一定是酸性氧化物 |


 Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为