题目内容
将物质的量之比为1:1的Na2CO3与NaHCO3溶于水配成等体积的溶液,则所得溶液中的钠离子的物质的量之比为 ;若将两种溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积比为 ,放出CO2的体积比为 .
考点:钠的重要化合物,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:根据钠守恒分析,物质的量之比为1:1的Na2CO3与NaHCO3溶于水则钠离子的物质的量之比2:1;与同浓度的盐酸完全反应,方程式分别为:Na2CO3+2HCl=2NaCl+CO2↑+H2O; NaHCO3+HCl=NaCl+CO2↑+H2O;最终都生成NaCl,所以氯离子之比等于钠离子的物质的量之比,根据氯守恒,则消耗盐酸的体积比为2:1;再根据碳守恒,放出CO2的体积比等于原来Na2CO3与NaHCO3中的碳原子之比,即1:1;
解答:
解:由钠原子守恒分析,物质的量之比为1:1的Na2CO3与NaHCO3溶于水则钠离子的物质的量之比2:1;与同浓度的盐酸完全反应,方程式分别为:
Na2CO3+2HCl=2NaCl+CO2↑+H2O; NaHCO3+HCl=NaCl+CO2↑+H2O;
根据反应最终都生成NaCl,所以氯离子之比等于钠离子的物质的量之比,由氯守恒,则消耗盐酸的体积比为2:1;再根据碳守恒,放出CO2的体积比等于原来Na2CO3与NaHCO3中的碳原子之比,即1:1;
故答案为:2:1;2:1;1:1;
Na2CO3+2HCl=2NaCl+CO2↑+H2O; NaHCO3+HCl=NaCl+CO2↑+H2O;
根据反应最终都生成NaCl,所以氯离子之比等于钠离子的物质的量之比,由氯守恒,则消耗盐酸的体积比为2:1;再根据碳守恒,放出CO2的体积比等于原来Na2CO3与NaHCO3中的碳原子之比,即1:1;
故答案为:2:1;2:1;1:1;
点评:本题主要考查的是碳酸钠与碳酸氢钠的性质以及相关计算,属于常考题,解题的关键是抓住反应前后原子守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是( )
| A、称重时发现砝码生锈 |
| B、定容时观察液面俯视 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量的蒸馏水 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| B、在含Fe3+的溶液:I-、K+、SCN-、Mg2+ |
| C、与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- |
| D、加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
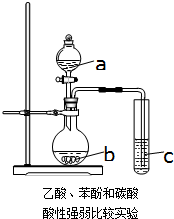 化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.
化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.

 Ⅱ.
Ⅱ.
 Na、Cu、Al、O、C、H是常见的六种元素.
Na、Cu、Al、O、C、H是常见的六种元素. 亚磷酸(H3P03 )是二元酸,H3 P03溶液中存在电离平衡:H3PO3?H-+H2PO3-亚磷酸与足量NaOH溶液反应,生成Na2 HPO3.
亚磷酸(H3P03 )是二元酸,H3 P03溶液中存在电离平衡:H3PO3?H-+H2PO3-亚磷酸与足量NaOH溶液反应,生成Na2 HPO3.