题目内容
13.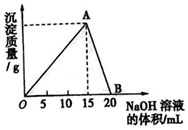 向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:(1)写出AB段发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)A点表示的意义是AlCl3与NaOH恰好完全反应,得到最大沉淀量.
(3)所用AlCl3溶液的物质的量浓度是0.5mol/L.
(4)当所得沉淀量为0.6g时,用去NaOH溶液的体积是11.5ml或16.2ml.
分析 开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
由于A→B消耗的氢氧化钠溶液体积为5mL,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)=0.01 mol,根据c=$\frac{n}{V}$计算氯化铝的物质的量浓度;
(4)0.6 g Al(OH)3的物质的量=$\frac{0.6g}{78g/mol}$=0.0077mol.当NaOH溶液不足时,生成0.6 g Al(OH)3所需NaOH的物质的量为0.023 mol;当NaOH溶液过量时,还剩余0.6g Al(OH)3,剩余的0.6 g Al(OH)3溶解可以消耗0.0077molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.0077mol=0.0323 mol,根据V=$\frac{n}{V}$计算NaOH溶液的体积.
解答 解:(1)AB段是生成的氢氧化铝溶于过量的氢氧化钠,故离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,
故答案为:AlCl3与NaOH恰好完全反应,得到最大沉淀量;
(3)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,
故氯化铝的物质的量浓度=$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:0.5mol/L;
(4)0.6 g Al(OH)3的物质的量=$\frac{0.6g}{78g/mol}$=0.0077mol.
当NaOH溶液不足时,生成0.6 g Al(OH)3所需NaOH的物质的量为0.023 mol,1故所需的氢氧化钠溶液的体积V1=$\frac{0.023mol}{2mol/L}$=0.0115L=11.5mL;
当NaOH溶液过量时,还剩余0.6g Al(OH)3,剩余的0.6 g Al(OH)3溶解可以消耗0.0077molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.0077mol=0.0323 mol,则所需的氢氧化钠溶液体积V2=$\frac{n}{V}$=$\frac{0.0323mol}{2mol/L}$=0.0162L=16.2mL.
故答案为:11.5;16.2.
点评 本题是AlCl3与NaOH反应与图象相结合的计算问题,考查了大家对图象的解读能力,分析问题能力、计算能力等,难度中等,本题解决的关键是明确NaOH溶液逐滴加入到AlCl3溶液中的反应情况.

| 氧化物 | 环境问题 | 主要来源 | |
| A | CO2 | 酸雨 | 化石燃料的燃烧 |
| B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
| C | NO2 | 温室效应 | 工厂废气的排放 |
| D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
| A. | A | B. | B | C. | C | D. | D |
| A. | c=$\frac{b}{11.2V}$ | B. | p=m+$\frac{{V}_{c}}{125}$ | C. | n=m+17Vc | D. | $\frac{17}{9}$m<p<$\frac{5}{3}$m |
| A. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| B. | 39g Na2O2与足量水充分反应时转移的电子数为0.5NA | |
| C. | 17 g羟基与17 g氨气所含电子数均为10NA | |
| D. | 1mol/L Na2SO4溶液中离子总数为3NA |
| A. | 溶液pH值从大到小的是③>②>①>④ | |
| B. | c(H2S) 从大到小是①>④>②>③ | |
| C. | 在H2S 和NaHS混合液中:2c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| D. | 在NaHS溶液中:c(H+)+c(Na+)═c(OH-)+c(HS-)+c(S2-) |
 世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )
世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )| A. | a极发生还原反应 | |
| B. | 正极的电极反应式为FeOx+2xe-═Fe+xO2- | |
| C. | 若有22.4L(标准状况)空气参与反应,则电路中转移4mol电子 | |
| D. | 铁表面发生的反应为xH2O(g)+Fe═FeOx+xH2 |
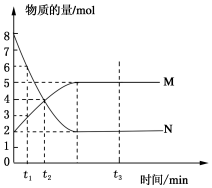 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: