题目内容
3.10.4g CH4和C2H4的混合气体在标准状况下的体积为11.2L,则混合气体中CH4与C2H4的物质的量之比为3:2.分析 n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合原子守恒及质量关系计算.
解答 解:n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,设混合气体中CH4与C2H4的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.5}\\{16x+28y=10.4}\end{array}\right.$
解得x=0.3mol,y=0.2mol,
混合气体中CH4与C2H4的物质的量之比为3:2,
故答案为:3:2.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
14.恒温、恒压下,在一个容积可变的容器中发生如下反应:N2+3H2?2NH3
(1)若开始时放入1mol N2和3mol H2,达到平衡后,生成a mol NH3
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为( )
(1)若开始时放入1mol N2和3mol H2,达到平衡后,生成a mol NH3
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为( )
| A. | 1mol和9mol | B. | 2mol和9mol | C. | 3mol和9mol | D. | 3mol和6mol |
18.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
8.NaHS不属于( )
| A. | 酸式盐 | B. | 含氧酸盐 | C. | 钠盐 | D. | 无氧酸盐 |
12.设 NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在反应 KClO3+6HCl═KCl+3Cl2↑+3H2O 中,Cl2既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA | |
| B. | 标准状况下,22.4 L 甲苯中含有的 C-H 键数目为 8NA | |
| C. | 50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA | |
| D. | t℃时,MgCO3的 Ksp=4×10-6,则该温度下饱和 MgCO3溶液中含有的 Mg2+数目为 2×10-3 NA |
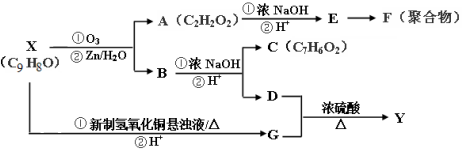
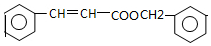 .
.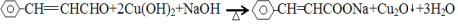 .
.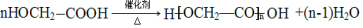 .
. .
.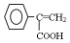 ,写出以
,写出以 为有机原料,制取H的合成路线(可任选无机原料).
为有机原料,制取H的合成路线(可任选无机原料).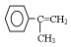 →
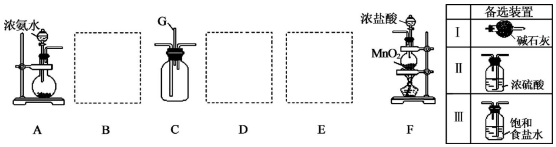
→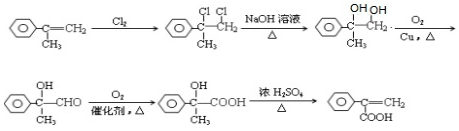 .
.
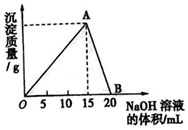 向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: