题目内容
15. 三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.
三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.(1)现用mg废铁屑(Fe2O3)制取FeCl3•6H2O晶体,并测定废铁屑中铁的质量分数,实验装置如图(夹持装置略).反应开始前至A中固体完全消失时,依次进行下列操作:
①缓慢滴加足量盐酸
②关闭弹簧夹K1、打开K2并关闭活塞a
③打开弹簧夹K1、关闭K2并打开活塞a
正确的操作顺序是③①②(填序号);当A中溶液完全进入烧杯后,烧杯中的现象是无色溶液逐渐变黄,有气泡产生,相应的离子方程式和化学方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O和2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验测得B中所得的气体VmL(标准状况),由此计算出该废铁屑中铁的质量分数是$\frac{V}{400m}$,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是:Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少.
(3)另取mg废铁屑和CO气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg,由此求出铁的准确质量分数是$\frac{m-\frac{10(m-w)}{3}}{m}$×100%(用含m和w的式子表示,无需化简).
分析 (1)装置A中的铁完全消失,反应结束;打开弹簧夹K2,反应生成的氯化亚铁被双氧水氧化成氯化铁,同时有氧气放出;根据氯化亚铁被双氧水氧化、生成的氯化铁作催化剂使双氧水分解情况,写出反应的离子方程式;
(2)“用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体”,氧化铁溶于盐酸,生成的三价铁离子能够消耗铁;
(3)根据质量减少的部分就是氧化铁中氧元素的质量,求出氧化铁的物质的量,再计算出铁的质量分数.
解答 解:(1)当A中固体完全消失,铁完全和盐酸反应后,反应结束,铁与盐酸反应的方程式是:Fe+2HCl=FeCl2+H2↑,;当A中溶液完全进入烧杯,生成的氯化亚铁被氧化成黄色的氯化铁溶液,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,生成的氯化铁作催化剂,使双氧水分解生成气体,反应的方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,收集测定生成的氧气体积,结合反应的定量关系计算,操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当A中固体完全消失时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3•6H2O晶体,所以依次进行下列操作:
①缓慢滴加足量盐酸
②关闭弹簧夹K1、打开K2并关闭活塞a
③打开弹簧夹K1、关闭K2并打开活塞a
正确的操作顺序是③①②,
故答案为:③①②;无色溶液逐渐变黄,有气泡产生;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)由于废铁屑中含有氧化铁,和盐酸反应生成的三价铁离子能够和铁反应,导致铁减少,置换的氢气体积减少,
故答案是:Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少;
(3)mg废铁屑中的氧化铁被还原后质量变成wg铁,质量差(m-w)g就是氧化铁中氧元素的质量,设废铁屑中氧化铁的质量为x
Fe2O3~3O
160 48
x (m-w)g
x=$\frac{160(m-w)g}{48}$=$\frac{10(m-w)}{3}$g,
铁屑中铁的质量分数为:$\frac{m-\frac{10(m-w)}{3}}{m}$×100%,
故答案为:$\frac{m-\frac{10(m-w)}{3}}{m}$×100%.
点评 本题考查了铁屑中铁的质量分数和制取氯化铁晶体,涉及了较多的化学方程式的书写、质量分数的计算、实验操作等知识,本题难度中等.

 步步高达标卷系列答案
步步高达标卷系列答案HUr(尿酸)+H2O?Ur-(尿酸根离子)+H3O+
Ur-(溶液)+Na+(溶液)?NaUr(固)
第一次关节炎发作大部分在寒冷季节脚趾和手指的关节处.下列叙述不正确的是( )
| A. | 尿酸酸性比盐酸弱 | B. | 尿酸钠的溶解度随温度升高而增大 | ||
| C. | 反应①为吸热反应,②为放热反应 | D. | 尿酸钠的熔点很低 |
| A. | 二氧化碳通过Na2O2粉末 | B. | 铝与Fe2O3发生铝热反应 | ||
| C. | 碳与SiO2电炉中抽取粗硅 | D. | 将锌片投入CuSO4溶液中 |
| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 将1molCu置于含2molH2SO4的浓溶液中加热 | |
| D. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 |
| A. | 0.4mol | B. | 0.2mol | C. | 0.225mol | D. | 无法计算 |
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol.
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ•mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加CO2的量或者升高温度.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
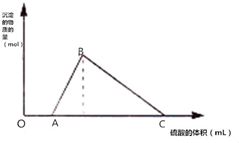 将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则
将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则