题目内容
6.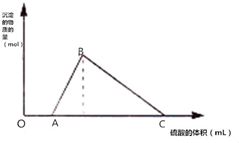 将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则
将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则(1)M=73,N=56;
(2)B点对应的横坐标数据是1000mL.
(3)写出图象中AB段发生反应的离子方程式AlO2-+H++H2O=Al(OH)3↓.
分析 钠铝的混合物置于水中,金属全部溶解,发生反应为2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑;由图象可知加入硫酸没有立即产生沉淀,则首先发生反应2NaOH+H2SO4═Na2SO4+2H2O,该阶段消耗硫酸500mL,说明金属钠过量,铝不足,过量的金属钠的物质的量为:n(Na)=n(NaOH)=2n(H2SO4)=2×1mol/L×0.5L=1mol;然后加入的硫酸发生反应2NaAlO2+H2SO4+2H2O═Na2SO4+2Al(OH)3↓,生成氢氧化铝沉淀;最后发生反应2Al(OH)3↓+3H2SO4═Al2(SO4)3+6H2O,加入2500mL硫酸溶液时,生成的氢氧化铝沉淀完全溶解,从偏铝酸钠开始沉淀至沉淀完全溶解总共消耗硫酸的物质的量为:1mol/L×(2.5L-0.5L)=2mol;根据反应2NaAlO2+4H2SO4═Na2SO4+Al2(SO4)3+4H2O及铝元素守恒可知:n(Al)=$\frac{1}{2}$n(H2SO4)=1mol,根据反应2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑可知,与铝反应消耗氢氧化钠的物质的量为:n(Na)=n(Al)=1mol,所以混合金属中含有钠的物质的量为:1mol+1mol=2mol,据此进行计算.
解答 解:钠铝的混合物置于水中,金属全部溶解,发生反应为:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
由图象可知,加入硫酸没有立即产生沉淀,则首先发生反应:2NaOH+H2SO4═Na2SO4+2H2O,该阶段消耗硫酸500mL,说明金属钠过量,铝不足,过量的金属钠的物质的量为:n(Na)=n(NaOH)=2n(H2SO4)=2×1mol/L×0.5L=1mol;
然后加入的硫酸发生反应:2NaAlO2+H2SO4+2H2O═Na2SO4+2Al(OH)3↓,生成氢氧化铝沉淀,
最后发生反应:2Al(OH)3↓+3H2SO4═Al2(SO4)3+6H2O,加入2500mL硫酸溶液时,生成的氢氧化铝沉淀完全溶解,
从偏铝酸钠开始沉淀至沉淀完全溶解总共消耗硫酸的物质的量为:1mol/L×(2.5L-0.5L)=2mol,
根据反应2NaAlO2+4H2SO4═Na2SO4+Al2(SO4)3+4H2O及铝元素守恒可知:n(Al)=$\frac{1}{2}$n(H2SO4)=1mol,根据反应2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑可知,与铝反应消耗氢氧化钠的物质的量为:n(Na)=n(Al)=1mol,所以混合金属中含有钠的物质的量为:1mol+1mol=2mol,
(1)混合金属的总质量为:Mg=27g/mol×1mol+23g/mol×2mol=73g;
根据电子守恒可知,钠和铝完全反应生成氢气的物质的量为:$\frac{1mol×3+2mol×1}{2}$=2.5mol,标准状况下2.5mol氢气的体积为:22.4L/mol×2.5mol=56L,即N=56,
故答案为:73;56;
(2)B点时铝元素完全转化成氢氧化铝沉淀,其溶质为硫酸钠,根据质量守恒可知:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(Na)=2mol×$\frac{1}{2}$=1mol,消耗1mol/L的硫酸溶液的体积为:$\frac{1mol}{1mol/L}$=1L=1000mL,
故答案为:1000;
(3)根据分析可知,AB段偏铝酸根离子与氢离子反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,
故答案为:AlO2-+H++H2O=Al(OH)3↓.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线变化对应的反应实质为解答关键,试题充分考查了学生的分析、理解能力及化学计算能力.

| A. | KI | B. | I2 | C. | I- | D. | KIO3 |
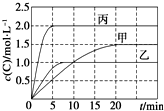 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
| A. | Na+、HCO3-、Ca2+、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Fe3+、NH4+、SO42- | D. | Mg2+、Na+、Cl-、CO32- |
| A. | 14gCO | B. | 32gO2 | C. | 44gCO2 | D. | 4gH2 |
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
| A. | 若恒容下,充入氮气,则c(SO3)小于0.04mol•L-1 | |
| B. | 该条件下反应的平衡常数为1.6×103 | |
| C. | v(O2)=0.02 mol•L-1.min-1 | |
| D. | 使用催化剂若平衡没有移动,则该反应达到化学平衡状态 |
 三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.
三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.