题目内容
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA |
| B、0.1 mol?L-1的Na2CO3溶液中Na+数为0.1NA |
| C、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA个碳原子 |
| D、0.5mol的甲基(-CH3)与氢氧根(OH-)所含电子数都为5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.重水的摩尔质量为20g/mol,计算出重水的物质的量及产生的氢气的物质的量;
B.碳酸钠溶液的体积不知道,无法计算溶液中含有的钠离子数目;
C.根据甲烷的物质的量计算出含有的碳氢共价键数目;
D.根据甲基没有发生电子的转移,氢氧根离子得到了电子分析.
B.碳酸钠溶液的体积不知道,无法计算溶液中含有的钠离子数目;
C.根据甲烷的物质的量计算出含有的碳氢共价键数目;
D.根据甲基没有发生电子的转移,氢氧根离子得到了电子分析.
解答:
解:A.20g重水的物质的量为1mol,与足量金属钠反应生成0.5mol氢气,产生气体的分子数为0.5NA,故A正确;
B.0.1 mol?L-1的Na2CO3溶液的体积没有告诉,无法计算碳酸钠的物质的量,故B错误;
C.120g的墨粉物质的量为10mol,即10NA个碳原子,能打a个字,则平均每个字约含有
个碳原子,故C错误;
D.0.5mol甲基含有4.5mol电子,0.5mol氢氧根离子含有5mol电子,二者含有的电子数不相等,故D错误;
故选A.
B.0.1 mol?L-1的Na2CO3溶液的体积没有告诉,无法计算碳酸钠的物质的量,故B错误;
C.120g的墨粉物质的量为10mol,即10NA个碳原子,能打a个字,则平均每个字约含有
| 10N A |
| a |
D.0.5mol甲基含有4.5mol电子,0.5mol氢氧根离子含有5mol电子,二者含有的电子数不相等,故D错误;
故选A.
点评:本题考查了考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意甲基与氢氧根离子中含有的电子数不相等,阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.

练习册系列答案
相关题目
根据如图,下列判断中正确的是( )
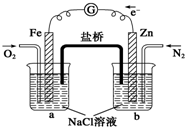

| A、烧杯a中的溶液pH不变 |
| B、烧杯a中发生氧化反应 |
| C、烧杯b中发生的反应为Zn-2e-=Zn2+ |
| D、烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
| ||
| A、溶液中c(Na+)=2c(SO42-) | ||
B、沉淀的物质的量等于
| ||
| C、标况下,生成SO2的体积<11.2aL | ||
D、原浓硫酸中H2SO4的物质的量>
|
设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1L0.5mol/L的HCl溶液中HCl分子数为0.5NA |
| C、常温常压下,32g氧气所含的氧原子数为2NA |
| D、18g NH4+所含的电子数为NA |
2014年10月24日双鸭山市区发生严重的雾霾天气,对人们的健康造成严重威胁,环境问题离我们也并不遥远了,则下列有关环境问题说法正确的是( )
| A、PH<7的雨水称为酸雨 |
| B、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
| C、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 |
| D、SO2、CO2、NO2均属于大气污染物 |
碳酸铵[(NH4)2CO3]室温下能自发地分解产生氨气,对其说法正确的是( )
| A、碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
| B、碳酸铵分解是因为外界给予了能量 |
| C、该反应的△H-T△S>0 |
| D、碳酸盐都不稳定,都能自发分解 |